Первый период периодической системы — Википедия
К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы верхней строки (или периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) химических свойств элементов при увеличении атомного числа: новая строка начинается тогда, когда увеличивается количество энергетических уровней, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего элементов. Их всего два: водород и гелий. Данное положение объясняется современной теорией строения атома.
К каждому периоду в периодической таблице химических элементов относятся как минимум 8 элементов, и это позволяет найти определённый периодический закон периода. Однако 1-й период содержит только 2 элемента, что затрудняет процесс нахождения периодического закона.
Гелий является благородным газом и относится к 18-й группе, принадлежащей благородным газам. А водород, как сказано ниже, имеет уникальные свойства и поэтому его трудно распределить в какую-либо группу. Именно поэтому его часто изображают на разных позициях в периодической таблице
Позиции элементов первого периода в таблице[править | править код]
Хотя и водород, и гелий, относятся к s-блоку, ни к одному из них невозможно найти элемент из этого же блока с похожими свойствами. Их химические свойства так сильно отличаются от других s-элементов, что порой возникают разногласия относительно положения элементов в периодической системе.
Водород в системе иногда размещают над литием[1], углеродом[2], фтором[2][3]. В некоторых вариантах таблицы символ водорода вообще появляется дважды — над литием и фтором[4]. Иногда же этот элемент размещают над всеми элементами ниже лежащих периодов таблицы, подчёркивая, что этот химический элемент не распределяется ни в одну из групп[4] периодической системы.
Гелий практически всегда располагают над неоном (относящемуся к р-элементам) в столбце, принадлежащему группе №18, где распмещены благородные газы [1]. Однако время от времени гелий размещали над бериллием ввиду одинаковых конфигураций расположения электронов на внешнем уровне[5].
Водород[править | править код]

 Водородная спектральная разрядная трубка
Водородная спектральная разрядная трубка 
Водород (Н) является химическим элементом с атомным номером 1. При нормальной температуре и давлении водород представляет собой легковоспламеняющийся двухатомный газ без цвета, запаха и вкуса. Неметалл, имеет молекулярную формулу H
Водород является самым распространённым химическим элементом, составляя примерно 75 % от массы всех элементов во Вселенной.[7] Звёзды в главной последовательности в основном состоят из водорода в состояние плазмы. В элементарном состоянии водород является относительно редким элементом на Земле, поэтому в промышленных масштабах он производится из таких углеводородов, как метан. Большинство элементарного водорода используется «немедленно» (имеется в виду локально на производственной площадке), крупнейшими местами его сбыта является переработка ископаемого топлива, гидрокрекинг, производство аммиака, в основном для рынка удобрений,и т.д. Водород можно получить также из воды с помощью процесса электролиза, но при этом производство водорода получается коммерчески значительно дороже, чем из природного газа. [8]
Наиболее распространенный изотоп водорода природного происхождения, известный как протий, имеет один протон и не имеет ни одного нейтрона.[9] В ионных соединениях он может либо получить положительный заряд, став катионом, состоящим из одного протона, либо приобрести отрицательный заряд, став анионом, известным как гидрид. Водород может вступать в соединения с большинством элементов, он присутствует в воде и в большинстве органических веществ.[10] Он играет особенно важную роль в химии кислот и оснований, в которой многие реакции представляют собой обмен протонами между молекулами раствора.[11] Поскольку только для нейтрального атома уравнение Шрёдингера может быть решено аналитически, изучение энергетики и спектра атома водорода играет ключевую роль в развитии квантовой механики.[12]
Взаимодействие водорода с различными металлами являются очень важным в металлургии, так как многие металлы при реакции испытывают водородное охрупчивание,
Гелий[править | править код]
 Гелиевая спектральная разрядная трубка
Гелиевая спектральная разрядная трубкаГелий (He) является одноатомным инертным химическим элементом с атомным номером 2, без цвета, вкуса и запаха, нетоксичным, стоящим в начале группы благородных газов в периодической таблице.[17] Его температура кипения и плавления являются самыми низкими среди всех элементов, он существует только в виде газа, за исключением экстремальных условий. [18]
Гелий был открыт в 1868 году французский астроном Пьером Жансеном, который первым обнаружил этот элемент по наличию неизвестной ранее жёлтой спектральной линии солнечного света во время солнечного затмения.[19] В 1903 году большие запасы гелия были найдены на месторождении природного газа в США, на сегодняшний день эта страна является крупнейшим поставщиком этого газа.[20] Гелий используется в криогенной технике,[21] в системах глубоководного дыхания,[22] для охлаждения сверхпроводящих магнитов, в гелиевом датировании,[23] для надувания воздушных шариков,[24] для подъёма дирижаблей,[25] и в качестве защитного газа для промышленных целей, таких как электросварка и выращивание кремниевых пластин.[26] Вдыхая небольшой объём газа, можно на время изменить тембр и качество человеческого голоса.[27] Поведение жидкого гелия-4 в двух жидких фазах гелий I и гелий II имеет важное значение для исследователей, изучающих квантовую механику и явления сверхтекучести в частности,
Гелий является вторым по лёгкости элементом и вторым по распространённости в доступной для наблюдения части Вселенной.[30] Большинство гелия образовалось во время Большого взрыва, но и новый гелий постоянно создаётся в результате слияния ядер водорода в звездах.[31] На Земле гелий относительно редок, он образуется в результате естественного распада некоторых радиоактивных элементов,[32] потому что альфа-частицы, которые при этом испускаются, состоят из ядер гелия. Этот радиогенный гелий улавливается в составе природного газа в концентрациях до семи процентов от объема,[33] из которого он добывается в коммерческих масштабах в процессе низкотемпературной сепарации, называемой фракционной перегонкой. [34]
В традиционном изображении периодической таблицы гелий находится над неоном, что отражает его статус благородного газа, однако иногда, как, например, в таблице Менделеева Джанета, он находится над бериллием, что отражает строение его электронной конфигурации.
- ↑ 1 2 International Union of Pure and Applied Chemistry > Periodic Table of the Elements (неопр.). IUPAC. Дата обращения 1 мая 2011.
- ↑ 1 2 Cronyn, Marshall W. The Proper Place for Hydrogen in the Periodic Table (англ.) // Journal of Chemical Education (англ.)русск. : journal. — 2003. — August (vol. 80, no. 8). — P. 947—951. — DOI:10.1021/ed080p947. — Bibcode: 2003JChEd..80..947C.
- ↑ Vinson, Greg. Hydrogen is a Halogen (неопр.). HydrogenTwo.com (2008). Дата обращения 14 января 2012.
- ↑ 1 2 Kaesz, Herb; Atkins, Peter. A Central Position for Hydrogen in the Periodic Table (англ.) // Chemistry International (англ.)русск. : journal. — International Union of Pure and Applied Chemistry. — Vol. 25, no. 6. — P. 14.
- ↑ Winter, Mark. Janet periodic table (неопр.) (недоступная ссылка). WebElements (1993–2011). Дата обращения 19 января 2012. Архивировано 6 апреля 2012 года.
- ↑ Hydrogen – Energy (неопр.). Energy Information Administration.
- ↑ Palmer, David Hydrogen in the Universe (неопр.). NASA (13 ноября 1997).
- ↑ Staff. Hydrogen Basics — Production (неопр.). Florida Solar Energy Center (2007).
- ↑ Sullivan, Walter. Fusion Power Is Still Facing Formidable Difficulties, The New York Times (11 марта 1971).
- ↑ «hydrogen», Encyclopædia Britannica, 2008
- ↑ Eustis, S. N.; Radisic, D; Bowen, KH; Bachorz, RA; Haranczyk, M; Schenter, GK; Gutowski, M. Electron-Driven Acid-Base Chemistry: Proton Transfer from Hydrogen Chloride to Ammonia (англ.) // Science : journal. — 2008. — 15 February (vol. 319, no. 5865). — P. 936—939. — DOI:10.1126/science.1151614. — PMID 18276886.
- ↑ «Time-dependent Schrödinger equation», Encyclopædia Britannica, 2008
- ↑ Rogers, H. C. Hydrogen Embrittlement of Metals (англ.) // Science. — 1999. — Vol. 159, no. 3819. — P. 1057—1064. — DOI:10.1126/science.159.3819.1057. — PMID 17775040.
- ↑ Christensen, C. H., Nørskov, J. K.; Johannessen, T.. Making society independent of fossil fuels — Danish researchers reveal new technology, Technical University of Denmark (9 июля 2005). Архивировано 7 января 2010 года.
- ↑ Takeshita, T.; Wallace, W.E.; Craig, R.S.
- ↑ Kirchheim, R. Hydrogen solubility and diffusivity in defective and amorphous metals (англ.) // Progress in Materials Science (англ.)русск. : journal. — 1988. — Vol. 32, no. 4. — P. 262—325. — DOI:10.1016/0079-6425(88)90010-2.
- ↑ Helium: the essentials (неопр.). WebElements.
- ↑ Helium: physical properties (неопр.). WebElements.
- ↑ Pierre Janssen (неопр.). MSN Encarta. Архивировано 29 октября 2009 года.
- ↑ Theiss, Leslie. Where Has All the Helium Gone? (неопр.). Bureau of Land Management (18 января 2007). Архивировано 25 июля 2008 года.
- ↑ Timmerhaus, Klaus D. Cryogenic Engineering: Fifty Years of Progress (англ.). — Springer (англ.)русск., 2006. — ISBN 0-387-33324-X.
- ↑ Copel, M. Helium voice unscrambling (неопр.) // Audio and Electroacoustics. — 1966. — September (т. 14, № 3). — С. 122—126. — DOI:10.1109/TAU.1966.1161862.
- ↑ «helium dating», Encyclopædia Britannica, 2008
- ↑ Brain, Marshall. How Helium Balloons Work (неопр.). How Stuff Works.
- ↑ Jiwatram, Jaya. The Return of the Blimp (неопр.). Popular Science (10 июля 2008).
- ↑ When good GTAW arcs drift; drafty conditions are bad for welders and their GTAW arcs (англ.) // Welding Design & Fabrication : journal. — 2005. — 1 February.
- ↑ Montgomery, Craig. Why does inhaling helium make one’s voice sound strange? (неопр.). Scientific American (4 сентября 2006).
- ↑ Probable Discovery Of A New, Supersolid, Phase Of Matter (неопр.). Science Daily (3 сентября 2004).
- ↑ Browne, Malcolm W.. Scientists See Peril In Wasting Helium; Scientists See Peril in Waste of Helium, The New York Times (21 августа 1979).
- ↑ Helium: geological information (неопр.). WebElements.
- ↑ Cox, Tony. Origin of the chemical elements (неопр.). New Scientist (3 февраля 1990).
- ↑ Helium supply deflated: production shortages mean some industries and partygoers must squeak by., Houston Chronicle (5 ноября 2006).
- ↑ Brown, David. Helium a New Target in New Mexico (неопр.). American Association of Petroleum Geologists (2 февраля 2008).
- ↑ Voth, Greg. Where Do We Get the Helium We Use?, The Science Teacher (1 декабря 2006).
D-элементы — Википедия
D-элементы — группа атомов в периодической таблице элементов (d-блок), в электронной оболочке которых валентные электроны с наивысшей энергией занимают d-орбиталь.
Данный блок представляет собой часть периодической таблицы; в него входят элементы от 3 до 12 группы[1][2]. Элементы данного блока заполняют d-оболочку d-электронами, которая у элементов начинается s2d1 (третья группа) и заканчивается s2d10 (двенадцатая группа). Однако существуют некоторые нарушения в этой последовательности, например, у хрома s1d5 (но не s2d4) вся одиннадцатая группа имеет конфигурацию s1d10 (но не s2d9). Двенадцатая группа имеет заполненные s- и d-электроны.
Элементы d-блока также известны как переходные металлы или переходные элементы. Однако точные границы, отделяющие переходные металлы от остальных групп химических элементов, ещё не проведены. Хотя некоторые авторы считают, что элементы, входящие в d-блок, являются переходными элементами[1], в которых d-электроны являются частично заполненными либо в нейтральных атомах или ионах, где степень окисления равна нулю[2][3]. ИЮПАК в данное время принимает такие исследования как достоверные и сообщает, что это относится только к 3—12 группам химических элементов[4]. Металлы 12ой вследствие полного заполнения d-оболочки не соответствуют классическому определению d-элементов, поэтому их можно считать и постпереходными металлами. Также было пересмотрено историческое применение термина «переходные элементы» и d-блока[5].
В s-блоке и p-блоке периодической таблицы аналогичные свойства, через периоды, как правило, не наблюдаются: самые важные свойства усиливаются по вертикали у нижних элементов данных групп. Примечательно, что различия элементов входящих в d-блок по горизонтали, через периоды, становятся более выраженными.
Лютеций и лоуренсий находятся в d-блоке, и они считаются не переходными металлами, но лантаноидами и актиноидами, что примечательно, таковыми считаются с точки зрения ИЮПАК[6]. Двенадцатая группа химических элементов хоть и находится в d-блоке, однако считается, что входящие в неё элементы являются постпереходными элементами[6].
Являются в организме человека в основном микроэлементами.Наряду с ферментами,гормонами,витаминами и другими биологически активными веществами микроэлементы участвуют в процессах обмена нуклеиновых кислот, белков,жиров и углеводов.Из d-элементов важную роль в организме играют железо,кобальт,цинк и молибден.Биологические функции микроэлементов в живом организме связаны главным образом с процессом комплексообразования между аминокислотами,белками, нуклеиновыми кислотами и ионами соответствующих металлов.Соединения d-элементов используются в качестве лекарственных препаратов, в избыточных концентрациях они ядовиты(это связано с тем, что d-элементы образуют с белками нерастворимые соединения).
Цинк входит в состав большого числа ферментов и гормона инсулина.Он необходим для нормальной концентрации витамина А в плазме.Влияет на синтез нуклеинвых кислот и участвует в передаче генетической информации.Соли цинка обладают антисептическим действием.
Марганец в организме содержится в количестве 0,36 ммоль.Входит в состав ферментов,катализирующих ОВР.Соединения марганца участвуют в синтезе витамина С в организме.Перманганат калия является окислителем и обладает антисептическим действием.
Железо в организме содержится в количестве равном приблизительно 5 граммам.Входит в состав гемоглобина.Избыток железа может привести к нарушению деятельности сердечно-сосудистой системы,печени,лёгких.
Кобальт входит в состав важных белковых молекул,активирует действие ряда ферментов.Дефицит кобальта в тканях снижает способность организма защищаться от различных инфекций.
Медь содержится в организме в количестве 1,1 ммоль.Активирует синтез гемоглобина,участвует в процессах клеточного дыхания,синтезе белка,образовании костной ткани и пигмента кожных покровов.Ионы медь входят в состав медьсодержащих ферментов(оксидаз), которые катализируют ОВР. Накопление меди в организме способствует развитию хронического гепатита.Избыток меди откладывается печени,мозге,почках,глазах, вызывает тяжелые заболевания-болезнь Вильсона.Все соли меди ядовиты.Токсичное действие обуславливается тем, что медь образует с белками нерастворимые альбуминаты, образуя прочную связь с аминным азотом и группой SH-белков.
Серебро-примесный микроэлемент, в организме содержится 7,3 ммоль.В медицине препараты серебра используют наружно, как вяжущее, прижигающее, бактерицидное средство.Серебро используется для получения «серебряной воды», которую используют для лечения ран,язв.Нитрат серебра в комплексе с органическими соединениями образует альбуминаты и вследствие денатурации белков бактериальных клеток оказывают бактерицидное действие.Нитрат серебра применяют при начальном, поверхностном,среднем кариесе, гиперестезии твёрдых тканей зуба и для стерилизации канала корня зуба.
Колларгол(серебро коллоидное) содержит 70% серебра.1-2 % раствор используют как антисептическое средство для полоскания полости рта при воспалительных процессах
Протаргол содержит 8% серебра, применяется как вяжущее, антисептическое и противовоспалительное средство.Используется в виде 1-5 % раствора для смазывания слизистой оболочки и для полоскания полости рта при воспалительных процессах.[7]
- ↑ 1 2 R.H. Petrucci, W.S. Harwood, F.G. Herring. «General Chemistry». — 8-е изд. — Prentice-Hall, 2002. — С. 341—342.
- ↑ 1 2 C.E. Housecroft и A.G. Sharpe. «Inorganic Chemistry». — 2-е изд. — Pearson Prentice-Hall, 2005. — С. 20—21.
- ↑ F.A. Cotton и G. Wilkinson. «Advanced Inorganic Chemistry». — 5-е изд. — John Wiley, 1988. — С. 625.
- ↑ Международный союз теоретической и прикладной химии. Transition element (неопр.). Compendium of Chemical Terminology. — Internet edition. Дата обращения 29 сентября 2011. Архивировано 8 мая 2012 года.
- ↑ Jensen, William B. «The Place of Zinc, Cadmium, and Mercury in the Periodic Table» (англ.) 952—961. Journal of Chemical Education (2003). Дата обращения 29 сентября 2011. Архивировано 8 мая 2012 года.
- ↑ 1 2 IUPAC Provisional Recommendations for the Nomenclature of Inorganic Chemistry (англ.) (2004). — online draft of an updated version of the «Red Book» IR 3—6. Дата обращения 29 сентября 2011. Архивировано 27 октября 2006 года.
- ↑ Кунцевич З.С., Морозова Э.Я. Учебно-методические разработки по самоподготовке к занятиям и выполнению лабораторных работ по общей химии для студентов лечебного факультета. — Витебск: ВГМУ, 2004. — С. 23-28. — 102 с.
- Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2-х томах. Пер. с англ. — М.: Мир, 1982. 652 с., ил. — Т. 1. — С. 437–451.
Группы химических элементов — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 мая 2015; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 мая 2015; проверки требуют 7 правок.Группа химических элементов — термин, используемый ИЮПАК для описания номенклатурной классификации химических элементов[1].
- Щелочные металлы — металлы первой группы: Li, Na, K, Rb, Cs, Fr.
- Щелочноземельные металлы — металлы второй группы: Be, Mg, Ca, Sr, Ba, Ra.
- Пниктогены (пниктиды[2]) — элементы пятой группы: N, P, As, Sb, Bi.
- Халькогены — элементы шестой группы: O, S, Se, Te, Po.
- Галогены (галоиды[2]) — элементы седьмой группы: F, Cl, Br, I, At.
- Инертные газы (благородные газы) — элементы восьмой группы: He, Ne, Ar, Kr, Xe, Rn.
- Лантаноиды (лантаниды[2]) — элементы 57—71: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
- Актиноиды (актиниды[2]) — элементы 89—103: Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
- Редкоземельные элементы — Sc, Y и лантаноиды.
- Переходные металлы — элементы побочных подгрупп.
Многие другие названия для групп элементов не утверждены ИЮПАК, но употребляются в различных областях науки. Например:
- Платиновая группа — Ru, Rh, Pd, Os, Ir, Pt.
- Благородные металлы — термин, который в основном используется для описания элементов, не подвергающихся коррозии — Au, Ag и металлы платиновой группы.
- Тяжёлые металлы — термин, использующийся для описания элементов с высокими значениями атомного веса (и/или плотности).
- Природные металлы — металлы, находящиеся в природе; не являются искусственно полученными.
- Постпереходные металлы — металлы, у которых наблюдается полное заполнение d-подоболочки: Zn, Ga, Cd, In, Sn, Hg, Tl, Pb, Bi.
- Лёгкие металлы — термин, иногда использующийся для описания некоторых металлов p-блока: алюминий, галлий, индий, олово, таллий, свинец и висмут (иногда в эту группу включают также германий, сурьму и полоний).
- Трансурановые элементы, трансураны — элементы, следующие за ураном (атомный номер больше 92).
- Трансплутониевые элементы — элементы, следующие за плутонием (атомный номер больше 94).
- Трансфермиевые элементы — элементы, следующие за фермием (атомный номер больше 100).
- Трансактиноидные элементы, трансактиноиды — элементы (они же сверхтяжёлые), следующие за актиноидами (атомный номер больше 103).
- Суперактиноиды — гипотетически возможная группа элементов, с атомными номерами 121—153 (которые входят в g-блок).
- Тяжёлый атом — термин, используемый в компьютерной химии для описания всех элементов, кроме водорода и гелия.
- Металлы — термин, используемый в астрофизике для описания всех элементов, кроме водорода и гелия.
Геохимические группы элементов[править | править код]
Классификация Гольдшмидта[править | править код]
- Атмофильные элементы — склонные к накоплению в атмосфере Земли, включают в себя кислород, водород, азот и инертные газы.
- Халькофильные элементы — элементы сульфидных руд. К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po.
- Литофильные элементы — обладающие сродством к силикатным минералам и расплавам. К ним относятся Al, At, B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Na, Nb, O, P, Rb, Sc, Si, Sr, Ta, Th, Ti, U, V, Y, Zr, W, лантаноиды.
- Сидерофильные элементы обладают сродством к железу. К ним относятся Au, Co, Fe, Ir, Mn, Mo, Ni, Os, Pd, Pt, Re, Rh, Ru.
Другие классификации[править | править код]
- Петрогенные элементы — основные элементы, составляющие породы и минералы: O, Si, Ti, Al, Mg, Fe, Ca, K, Mn, P, Na, K
- Редкие/редкоземельные и рассеянные элементы — все остальные элементы
Биохимические группы элементов[править | править код]
- Биологически значимые элементы
- Макроэлементы — суточное поступление в организм человека более 200 мг
- Микроэлементы — бор, фтор, кремний, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, мышьяк, селен, молибден, иод
- Биологически инертные элементы
Подгруппа меди — Википедия
| Группа → | 11 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 4 | |||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Подгру́ппа ме́ди — химические элементы 11-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы I группы)[1].
В группу входят переходные металлы, из которых традиционно изготавливают монеты: медь Cu, серебро Ag и золото Au. На основании строения электронной конфигурации, к этой же группе относится и рентгений Rg, но в «монетную группу» он не попадает (это недолго живущий трансактинид с периодом полураспада 26 сек). Название монетные металлы официально не применяется к 11 группе элементов, поскольку для изготовления монет используются и другие металлы, такие как алюминий, свинец, никель, нержавеющая сталь и цинк.
Все элементы этой группы, кроме рентгения, известны человечеству с доисторических времён, поскольку все они встречаются в природе в металлической форме, и для их производства не требуются сложные металлургические процессы.
Наряду с железом эти элементы играли значительную роль в становлении цивилизации, а по названиям некоторых элементов названы периоды развития человечества, как реальные — «Медный век», так и вымышленные — «Золотой век». Также можно вспомнить «Железный век», «Бронзовый век» и «Серебряный век».
Вероятнее всего Медь, Серебро и Золото являются первыми открытыми человечеством элементами, так как встречаются в природе в самородном состоянии.
Спортсмены, занимающие призовые места на соревнованиях, получают золотые, серебряные и бронзовые медали.
Все элементы подгруппы являются относительно химически инертными металлами. Характерны также высокие значения плотности, но относительно небольшие температуры плавления и кипения, высокая тепло- и электропроводность.
Свойства металлов подгруппы меди[2]
| Атомный номер | Название, символ | Электронная конфигурация | Степени окисления | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|
| 29 | Медь Cu | [Ar] 3d104s1 | 0, +1, +2 | 8,96[3][4] | 1083[3][4] | 2543[3][4] |
| 47 | Серебро Ag | [Kr] 4d105s1 | 0, +1, +2 | 10,5[5] | 960,8[5] | 2167[5] |
| 79 | Золото Au | [Xe] 4f145d106s1 | 0, +1, +3 | 19,3[6] | 1063,4[6] | 2880[6] |
Особенностью элементов подгруппы является наличие заполненного предвнешнего (n−1)d{\displaystyle (n-1)d}-подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[7]
Эти металлы, особенно серебро, имеют необычные свойства, которые придают им важное значение для промышленного применения, помимо их значения в качестве денежной и декоративной ценности. Они являются отличными проводниками электричества, самыми лучшими среди всех металлов. Серебро также является самым лучшим теплопроводящим элементом и самым лучшим отражателем света, а также имеет такое необычное свойство, как чернение, образование на его поверхности тёмного слоя, при этом электропроводность его не ухудшается.
Медь широко используется для электрических соединений в схемотехнике. Иногда в особо точном оборудовании электрические контакты изготавливают из золота ввиду его высокой коррозийной стойкости. Серебро также широко используется в критически важных случаях для изготовления электрических контактов. Также оно используется в фотографии (потому что под действием света из нитрата серебра происходит выпадение серебра), сельском хозяйстве, медицине, аудиофилии и в научных приложениях.
Золото, серебро и медь являются довольно мягкими металлами, поэтому при ежедневном использовании в качестве монет происходит быстрый выход их из строя, драгоценные металлы легко истираются в процессе применения. Для нумизматических функций эти металлы должны быть легированы другими металлами, чтобы повысить их износостойкость.
Золотые монеты: золотые монеты, как правило, производятся из сплава с 90 % золота (например, монеты США до 1933 г.), или чистотой 22 карат (92 % золота, как например, современные коллекционные монеты и крюгерранд), остальное медь и серебро. Весовые золотые монеты содержат до 99,999 % золота (например, в канадских монетах серии «Кленовый лист»).
Серебряные монеты: серебряные монеты содержат, как правило, 90 % серебра (как, например, чеканились монеты США до 1965 г., которые были распространены во многих странах), или, как в стерлинге, 92,5 % серебра, как в монетах Британского Содружества до 1967 г. и других чеканках из серебра, остальное составляет медь.
Медные монеты: медные монеты часто имеют весьма высокую чистоту, около 97 %, и, как правило, легированы небольшим количеством цинка и олова.
Инфляция привела к снижению номинальной стоимости монет, они уже не являются той твёрдой валютой, которой были исторически. Это привело к тому, что современные монеты стали делать из цветных металлов: мельхиор (медь и никель в пропорции 80:20, чёрного цвета), никель-латунь (медь, никель и цинк в пропорции 75:5:20, золотистого цвета), марганец-латунь (медь, цинк, марганец и никель), бронза, а также просто сталь с гальванопокрытием.
- Металлы подгруппы меди
-

Кристаллы меди
-

Кристаллы серебра
-

Кристаллы золота
Элементы формы
Элементы формы предназначены для отображения и редактирования данных в форме. Также как и сама форма, элементы связаны с данными при помощи реквизитов формы:
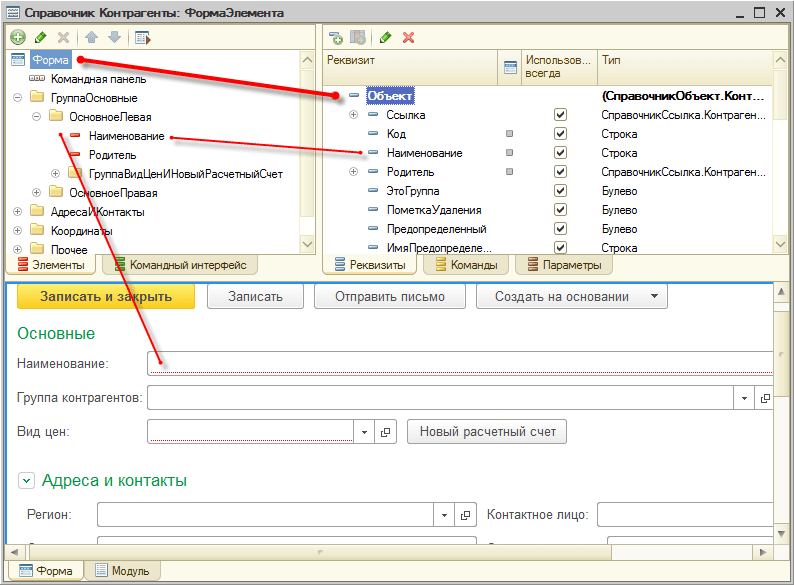
Поведение элементов, определяемое данными
Благодаря этой связи у пользователя появляется возможность изменять данные, описанные в реквизитах формы. Кроме этого, связь элементов управления с данными определяет и поведение самих элементов управления.
Например, если элемент поле ввода, связать с данными, имеющими тип Строка, то оно будет иметь следующий вид:

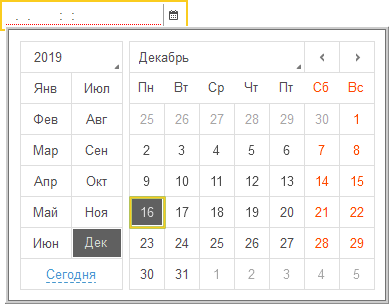
Если же поле ввода связать с данными, имеющими тип Дата, то внешний вид поля ввода изменится: появятся символы разделителей даты и дополнительная кнопка выбора:

При нажатии на кнопку выбора будет открываться окно календаря, позволяющее выбирать нужную дату нажатием мыши:
Если же поле ввода связать с каким-либо объектом прикладного решения, то у него появятся две дополнительные кнопки: кнопка просмотра и кнопка открытия, имеющая уже другую пиктограмму, т. к. предназначена для выбора нужного объекта прикладного решения из формы списка:

Элементы, ориентированные на бизнес-задачи
Поля ввода
Элементы, используемые в формах 1С:Предприятия, ориентированы на выполнение бизнес-задач. Например, поле ввода может иметь ряд дополнительных кнопок: выбора из списка, выбора, очистки, регулирования и открытия. Кроме этого, у поля ввода существует режим автоотметки незаполненного (подчеркивание красным пунктиром), который позволяет выделять поля, обязательные для заполнения пользователем:

Действия, выполняемые при нажатии дополнительных кнопок поля ввода, могут быть различными, в зависимости от типа данных, которые отображаются в этом поле; при этом кнопка выбора будет иметь разные пиктограммы:
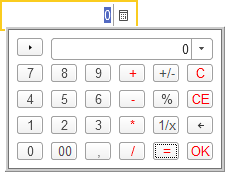
Например, для поля ввода, содержащего число, нажатие на кнопку выбора будет приводить к открытию калькулятора:
А для поля ввода, содержащего дату, нажатие той же самой кнопки будет приводить к открытию календаря:
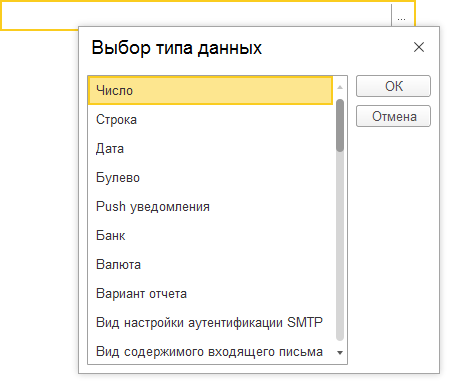
Редактирование в одном элементе любых типов данных
Поскольку платформа 1С:Предприятия допускает хранение в полях базы данных различного типа, элементы управления также обеспечивают ввод и редактирование различных типов данных в одном элементе. Например, если в поле ввода могут быть введены данные различных типов, то при нажатии на кнопку выбора система откроет специальное окно для выбора типа данных, которые будут содержаться в этом поле:
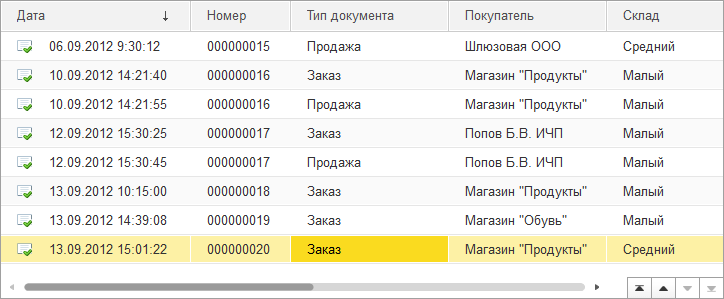
Динамические списки
Элемент формы Таблица позволяет отображать и редактировать динамические списки, содержащие информацию из базы данных. Такие списки могут быть отсортированы простым нажатием мыши на заголовке нужной колонки и поддерживают различные варианты фильтрации и возможность интерактивного управления расположением колонок. Подробнее…
Автоматическое изменение расположения и размеров элементов формы при изменении размеров окна
В платформе 1С:Предприятия 8 реализован механизм автоматического изменения расположения и размеров элементов, который обеспечивает автоматическое выравнивание всех элементов управления, поддерживает разделители внутри окна и тем самым позволяет при разработке формы для объекта не заботиться о том, как она будет отображаться при изменениях размеров окон.
Список химических элементов — это… Что такое Список химических элементов?
Список химических элементов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ (признанный Международным союзом теоретической и прикладной химии), группа и период в Периодической системе химических элементов, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| № | Название | Символ | Латинское название | Период, группа | Атомная масса (г/моль) | Плотность (г/см³) при 20 °C | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | Hydrogenium | 1, 1 | 1,00794 (7)[1][2][3] | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | Helium | 1, 18 | 4,002602 (2)[1][3] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Локьер, Жансен (в спектре Солнца), Рамзай (на Земле) |
| 3 | Литий | Li | Lithium | 2, 1 | 6,941 (2)[1][2][3][4] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | Beryllium | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | Borum | 2, 13 | 10,811 (7)[1][2][3] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | Carboneum | 2, 14 | 12,0107 (8)[1][3] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | Nitrogenium | 2, 15 | 14,0067 (2)[1][3] | 1,17 г/л | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | Oxygenium | 2, 16 | 15,9994 (3)[1][3] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | Ftorum, Fluorum | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | Neon | 2, 18 | 20,1797 (6)[1][2] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Траверс |
| 11 | Натрий | Na | Natrium | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | Magnesium | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1808 | Дэви |
| 13 | Алюминий | Al | Aluminium | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | Silicium | 3, 14 | 28,0855 (3)[3] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | Phosphorum | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | Sulfurum | 3, 16 | 32,065 (5)[1][3] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | Chlorum | 3, 17 | 35,453 (2)[1][2][3] | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | Argon | 3, 18 | 39,948 (1)[1][3] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | Kalium, Calium | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | Calcium | 4, 2 | 40,078 (4)[1] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | Scandium | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | Titanium | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | Vanadium | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | Chromium | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | Manganum, Manganesium | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | Ferrum | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | Cobaltum | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | Niccolum | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | Cuprum | 4, 11 | 63,546 (3)[3] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | Zincum | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | Gallium | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | Germanium | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | Arsenicum | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | Selenium | 4, 16 | 78,96 (3)[3] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | Bromum | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | Krypton, Crypton | 4, 18 | 83,798 (2)[1][2] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Траверс |
| 37 | Рубидий | Rb | Rubidium | 5, 1 | 85,4678 (3)[1] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | Strontium | 5, 2 | 87,62 (1)[1][3] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | Yttrium | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | Zirconium | 5, 4 | 91,224 (2)[1] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | Niobium | 5, 5 | 92,90638 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | Molybdaenum | 5, 6 | 95,94 (2)[1] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | Technetium | 5, 7 | [98,9063][5] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | Ruthenium | 5, 8 | 101,07 (2)[1] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | Rhodium | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Волластон |
| 46 | Палладий | Pd | Palladium | 5, 10 | 106,42 (1)[1] | 12,02 | 1552 | 3140 | 1803 | Волластон |
| 47 | Серебро | Ag | Argentum | 5, 11 | 107,8682 (2)[1] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | Cadmium | 5, 12 | 112,411 (8)[1] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | Indium | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | Stannum | 5, 14 | 118,710 (7)[1] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | Stibium | 5, 15 | 121,760 (1)[1] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | Tellurium | 5, 16 | 127,60 (3)[1] | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | Iodium, Jodium | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | Xenon | 5, 18 | 131,293 (6)[1][2] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Траверс |
| 55 | Цезий | Cs | Caesium | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | Barium | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | Lantanum | 6 | 138,90547 (7)[1] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | Cerium | 6 | 140,116 (1)[1] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | Prasaeodymum | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | Ауэр фон Вельсбах |
| 60 | Неодим | Nd | Neodymum | 6 | 144,242 (3)[1] | 7,00 | 1010 | 3127 | 1895 | Ауэр фон Вельсбах |
| 61 | Прометий | Pm | Prometium | 6 | [146,9151][5] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | Samarium | 6 | 150,36 (2)[1] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | Europium | 6 | 151,964 (1)[1] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | Gadolinium | 6 | 157,25 (3)[1] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | Terbium | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | Dysprosium | 6 | 162,500 (1)[1] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | Holmium | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | Erbium | 6 | 167,259 (3)[1] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | Thulium | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | Ytterbium | 6 | 173,04 (3)[1] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | Lutetium | 6, 3 | 174,967 (1)[1] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | Hafnium | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | Tantalum | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | Wolfrahmium | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | Rhenium | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5873 | 1925 | Ноддак, Такке и Берг |
| 76 | Осмий | Os | Osmium | 6, 8 | 190,23 (3)[1] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | Iridium | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | Platinum | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | Aurum | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | Hydrargyrum | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | Thallium | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | Plumbum | 6, 14 | 207,2 (1)[1][3] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | Bismuthum, Wismatum | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | Polonium | 6, 16 | [208,9824][5] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | Asthatum | 6, 17 | [209,9871][5] | 302 | 337 | 1940 | Д. Р. Корсон, К. Р. Маккензи и Э. Сегре | |
| 86 | Радон | Rn | Radon | 6, 18 | [222,0176][5] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | Francium | 7, 1 | [223,0197][5] | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | Radium | 7, 2 | [226,0254][5] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | Actinium | 7 | [227,0278][5] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | Thorium | 7 | 232,03806 (2)[5][1] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | Protactinium | 7 | 231,03588 (2)[5] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | Uranium | 7 | 238,02891 (3)[5][1][2] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | Neptunium | 7 | [237,0482][5] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | Plutonium | 7 | [244,0642][5] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | Americium | 7 | [243,0614][5] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | Curium | 7 | [247,0703][5] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | Berklium | 7 | [247,0703][5] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | Californium | 7 | [251,0796][5] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | Einsteinium | 7 | [252,0829][5] | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | Fermium | 7 | [257,0951][5] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | Mendelevium, Mendeleevium, Mendeleievium | 7 | [258,0986][5] | 1955 | Сиборг | |||
| 102 | Нобелий | No | Nobelium | 7 | [259,1009][5] | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | Lawrencium, Laurentium | 7, 3 | [260,1053][5] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | Rutherfordium | 7, 4 | [261,1087][5] | 1964/69 | Флёров | |||
| 105 | Дубний | Db | Dubnium | 7, 5 | [262,1138][5] | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | Seaborgium | 7, 6 | [263,1182][5] | 1974 | Флёров | |||
| 107 | Борий | Bh | Bohrium | 7, 7 | [262,1229][5] | 1976 | Оганесян | |||
| 108 | Хассий | Hs | Hassium | 7, 8 | [265][5] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | Meitnerium | 7, 9 | [266][5] | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | Darmstadtium | 7, 10 | [269][5] | 1994 | GSI | |||
| 111 | Рентгений | Rg | Roentgenium | 7, 11 | [272][5] | 1994 | GSI | |||
| 112 | Коперниций | Cn | Copernicium | 7, 12 | [285][5] | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284][5] | 2004 | ОИЯИ (*), LLNL (*) | ||||
| 114 | Флеровий | Fl | Flerovium, Fliorovium | 7, 14 | [289][5] | 1999 | ОИЯИ | |||
| 115 | Унунпентий | Uup | 7, 15 | [288][5] | 2004 | ОИЯИ, LLNL | ||||
| 116 | Ливерморий | Lv | Livermorium | 7, 16 | [292][5] | 2000 | ОИЯИ, LLNL | |||
| 117 | Унунсептий | Uus | 7, 17 | [295][5] | 2010 | ОИЯИ | ||||
| 118 | Унуноктий | Uuo | 7, 18 | [294][5] | 2004 | ОИЯИ |
Аббревиатуры
- GSI — Gesellschaft für Schwerionenforschung (Институт тяжёлых ионов), Виксхаузен, Дармштадт, Германия
- ОИЯИ — Объединённый институт ядерных исследований, Дубна, Московская область, Россия (JINR, Joint Institute for Nuclear Research)
- LLNL — Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э. Лоуренса), Ливермор, Калифорния, США
- LBNL — Lawrence Berkeley National Laboratory (Национальная лаборатория имени Лоуренса в Беркли), Беркли, Калифорния, США
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ 1 2 3 4 5 6 7 8 Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Данный элемент не имеет стабильных изотопов, и значение в скобках, например, [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
Второй период периодической системы — Википедия
Ко второ́му пери́оду периоди́ческой систе́мы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Второй период содержит больше элементов, чем предыдущий, в него входят: литий, бериллий, бор, углерод, азот, кислород, фтор и неон. Данное положение объясняется современной теорией строения атома.
Литий[править | править код]
Литий (Li) является химическим элементом с атомным номером 3, встречающимся в двух изотопах: 6Li и 7Li. При нормальной температуре и давлении литий — это серебристо-белый, мягкий щелочной металл с высокой реакционной способностью. Его плотность составляет 0.564 г/см³. Литий является самым лёгкий из всех металлов и наименее плотным из всех твёрдых элементов.[1] Наиболее распространённым в природе изотопом является литий-7, обозначающийся как 7Li, который составляет 92,5% всего лития. Такой изотоп состоит из трёх протонов и четырёх нейтронов.[2] Изотоп литий-6, обозначающийся 6Li, тоже стабилен, он содержит три протона и три нейтрона. Эти два изотопа составляют весь естественный литий на Земле, хотя искусственно были синтезированы и другие изотопы.[2] В ионных соединениях литий теряет электрон и становится положительно заряженным катионом Li+.
Согласно теории, Li является одним из немногих элементов, синтезированных в результате Большого Взрыва, вследствие чего его относят к списку изначальных элементов. Литий стоит на 33 месте среди самых распространённых элементов на Земле,[3] встречаясь в концентрациях от 20 до 70 миллионных долей по весу,[4] но из-за его высокой реакционной способности в природе он встречается только в виде соединений. Наиболее богатым источником литий-содержащих соединений являются гранитные пегматиты, а также сподумен и петалит, которые являются наиболее коммерчески целесообразными источниками этого элемента.[4] Металл выделяется электролитически из смеси хлорида лития и хлорида калия.
Соли лития используются в фармакологической промышленности как лекарственное средство для стабилизации настроения.[5][6] Они используются также при лечении биполярного расстройства, где играют определённую роль в лечении депрессии и мании, и могут уменьшить шансы суицида.[7] Наиболее распространёнными из применяемых соединений лития являются карбонат лития Li2CO3, цитрат лития Li3C6H5O7, сульфат лития Li2SO4 и оротат лития LiC5H3N2O4·H2O. Литий используется также в качестве анода в литиевых батареях, а его сплавы с алюминием, кадмием, медью и марганцем используются для высокопрочных частей самолетов и космических аппаратов, например, для внешнего топливного бака космического корабля Спейс шаттл.[1]
Бериллий[править | править код]
Бериллий (Be) является химическим элементом с атомным номером 4, существующем в виде 9Be. При нормальной температуре и давлении бериллий является твёрдым, лёгким, хрупким, двухвалентным щёлочноземельным металлом серо-стального цвета, с плотностью 1,85 г/см³.[8] Он обладает одной из самых высоких температур плавления среди всех лёгких металлов. Наиболее распространенным изотопом бериллия является 9Be, который содержит 4 протона и 5 нейтронов. Он составляет почти 100% всего природного бериллия, и является единственным стабильным изотопом, однако искусственно были синтезированы и другие изотопы. В ионных соединенийях бериллий теряет два валентных электрона с образованием катиона Be2+.
Небольшое количество атомов бериллия было синтезировано во время Большого Взрыва, хотя большинство из них распались или участвовали в дальнейшем в атомных реакциях при создания более крупных ядер, таких как углерод, азот и кислород. Бериллий является одним из компонентов в 100 из более 4000 известных минералов, таких как бертрандит Be4Si2O7(OH)2, берилл Al2Be3Si6O18, хризоберилл Al2BeO4 и фенакит Be2SiO4. Драгоценные формы берилла — аквамарин, берилл красный и изумруд. Наиболее распространенными источниками бериллия, используемого в коммерческих целях, являются берилл и бертрандит, и при его производстве используется реакция восстановления фторида бериллия с помощью металлического магния или электролиз расплавленного хлорида бериллия, содержащего некоторое количество хлорида натрия, поскольку хлорид бериллия является плохим проводником электричества.[8]
Благодаря высокой жёсткости, легкому весу и стабильности размеров в широком диапазоне температур, металлический бериллий используется в качестве конструкционного материала в авиации, ракетной технике и спутниковой связи.[8] Он используется в качестве легирующей добавки в бериллиевой бронзе, которая используется в электрических компонентах ввиду её высокой электро- и теплопроводности.[9] Листы бериллия используются в рентгеновских детекторах для фильтрации видимого света и пропуска только рентгеновских лучей.[8] Он используется в качестве замедлителя нейтронов в ядерных реакторах, поскольку лёгкие ядра более эффективны в замедлении нейтронов, чем тяжёлые.[8] Низкий вес и высокая жёсткость бериллия делают полезным его применение в высокочастотных громкоговорителях (твитерах).[10]
Бериллий и его соединения отнесены Международным агентством по изучению рака к 1 группе канцерогенов. Они обладают канцерогенными свойствами как для людей, так и для животных.[11] Хронический бериллиоз является лёгочным, гранулематозным заболеванием большого круга кровообращения, вызванным воздействием бериллия. Приблизительно 1% — 15% людей чувствительны к бериллию, и у них могут развиться воспалительные реакции дыхательной системы и кожи, которые называются хронической бериллиевой болезнью или бериллиозом. Иммунная система организма распознаёт бериллий как инородные частицы и подготавливает против них атаку, как правило, в лёгких, через которые эти частицы вдыхаются. Эта реакция может вызвать лихорадку, усталость, слабость, ночные потовыделения и затруднение дыхания.[12]
Бор[править | править код]
Основная статья: БорБор (B) является химическим элементом с атомным номером 5, существующем в виде 10B и 11B. При нормальной температуре и давлении бор является трёхвалентным металлоидом, имеющем несколько аллотропных форм. Аморфный бор представляет собой коричневый порошок, образующийся как продукт многих химических реакций. Кристаллический бор является очень твёрдым, чёрным материалом с высокой температурой плавления, существующем во многих полиморфных модификациях. Наиболее распространёнными являются две ромбоэдрические модификации: α-бор и β-бор, содержащие 12 и 106,7 атомов в ромбоэдрической ячейке соответственно, и 50-атомный бор с тетрагональной решёткой. Бор имеет плотность 2,34 г/см³.[13] Наиболее распространённым в природе изотопом бора является 11B (80,22% от всего бора), содержащий 5 протонов и 6 нейтронов. Другой встречающийся изотоп 10B (19,78%) содержит 5 протонов и 5 нейтронов.[14] Но это только стабильные изотопы, а искусственно были синтезированы и другие. Бор создаёт ковалентные связи с другими неметаллами и имеет степень окисления 1, 2, 3 и 4.[15][16][17] В свободном виде в природе бор не встречается, а встречается в таких соединениях, как бораты. Наиболее распространёнными источниками бора являются турмалин, бура Na2B4O5(OH)4·8H2O и кернит Na2B4O5(OH)4·2H2O.[13] Чистый бор получить довольно трудно. Сделать это можно путём его восстановления магнием из оксида бора B2O3. Этот оксид получают путём плавления борной кислоты B(OH)3, которая в свою очередь получается из буры. Небольшое количество чистого бора можно получить путём термического разложения трибромида бора BBr3 в газообразном водороде над горячей проволокой из вольфрама или тантала; последние действуют в качестве катализаторов.[13] Коммерчески наиболее важными источниками бора являются: пентагидрат тетрабората натрия Na2B4O7 · 5H2O, который в больших количествах используется при производстве изоляционного стекловолокна и отбеливателя из пербората натрия; карбид бора, керамический материал, используемый для изготовления бронированных изделий, особенно бронежилетов для солдат и сотрудников полиции; ортоборная кислота H3BO3 и борная кислота, используемые в производстве текстильного стекловолокна и плоскопанельных дисплеев; декагидрат тетрабората натрия Na2B4O7 · 10H2O и бура, используемые в производстве клеев; наконец, изотоп бор-10 используется в управлении ядерными реакторами в качестве защиты от ядерного излучения и в приборах для обнаружения нейтронов.[14]
Бор является одним из важнейших микроэлементов растений, необходимый для создания и роста прочных клеточных мембран, деления клеток, развития семян и плодов, транспортировки сахаров и развития гормонов.[18][19] Однако концентрация его в почве более 1.0 мд может вызвать некроз листьев и плохой рост. Уровень около 0.8 мд может вызвать эти же симптомы у растений особенно чувствительных к бору. У большинства растений, даже не слишком чувствительных к наличию бора в почве, признаки отравления бором появляются при уровне выше 1.8 мд.[14] В организме животных бор является ультраразличимым элементом (англ.). В диете человека ежедневный приём составляет 2.1-4.3 мг бора в день на килограмм массы тела.[20] Он также используется как добавка для профилактики и лечения остеопороза и артрита.[21]
Углерод[править | править код]
Углерод (C) является химическим элементом с атомным номером 6, встречающемся в природе в виде 12C, 13C и 14C.[22] При нормальной температуре и давлении углерод является твёрдым веществом, существующем в различных аллотропных формах, наиболее распространенными из которых являются графит, алмаз, фуллерены и аморфный углерод.[22] Графит — мягкий, матово-чёрный полуметалл с гексагональной кристаллической решёткой, с очень хорошими проводящими и термодинамически стабильными свойствами. Алмаз имеет весьма прозрачные бесцветные кристаллы с кубической решёткой и с плохими проводящими свойствами, он является самым твёрдым из известных естественных минералов и имеет самый высокий показатель преломления среди всех драгоценных камней. В отличие от структур алмаза и графита типа кристаллической решётки, фуллерены, названные в честь Ричарда Бакминстера Фуллера, являются веществами, архитектура которых напоминает молекулы. Есть несколько различных фуллеренов, наиболее известным из которых является «бакминстерфуллерен» C60, название которого также связано с именем Ричарда Бакминстера Фуллера. Пространственная структура этого фуллерена напоминает геодезический купол, изобретённый Фуллером. О фуллеренах известно пока немного, они являются предметом интенсивных исследований.[22] Существует также аморфный углерод, который не имеет кристаллической структуры.[23] В минералогии этот термин используется для ссылки на сажу и уголь, хотя они не являются строго аморфными, поскольку содержат небольшое количество графита или алмаза.[24][25] Наиболее распространённым изотопом углерода является 12C с шестью протонами и шестью нейтронами (98,9% от общего количества).[26] Стабилен также изотоп 13C с шестью протонами и семью нейтронами (1,1%).[26] Ничтожные количества 14C также встречаются в природе, но этот изотоп является радиоактивным и распадается с периодом полураспада 5730 лет. Он используется в методе радиоуглеродного датирования.[27] Искусственно синтезированы также другие изотопы углерода. Углерод образует ковалентные связи с другими неметаллами со степенью окисления -4, -2, +2 и +4.[22]
Углерод является четвёртым по распространённости элементом во Вселенной по массе после водорода, гелия и кислорода,[28] вторым в организме человека по массе после кислорода[29] и третьим по числу атомов.[30] Существует чуть ли не бесконечное число соединений, содержащих углерод, благодаря способности углерода к образованию стабильной связи C — С.[31][32] Простейшими углеродосодержащими молекулами являются углеводороды,[31] которые включают углерод и водород, хотя иногда они содержат в функциональных группах и другие элементы. Углеводороды используются в качестве топлива, для производства пластмасс и в нефтехимии. Все органические соединения, необходимые для жизни, содержат по меньшей мере один атом углерода.[31][32] В соединении с кислородом и водородом углерод может образовывать многие группы важных биологических соединений,[32] включая сахара, лигнаны, хитины, спирты, жиры и ароматические эфиры, каротиноиды и терпены. С азотом он образует алкалоиды, а с добавлением серы формирует антибиотики, аминокислоты и резину. С добавлением фосфора к этим элементам углерод формирует ДНК и РНК, химические коды носителей жизни, и аденозинтрифосфаты (АТФ), являющиеся наиболее важными переносчиками энергии для молекул во всех живых клетках.[32]
Азот[править | править код]
Азот (N) является химическим элементом с атомным номером семь и атомной массой 14,00674. При стандартных условиях азот в природе представляет собой инертный двухатомный газ без цвета, вкуса и запаха, составляющий 78,08% от объёма атмосферы Земли. Азот был открыт как составная компонента воздуха шотландским врачом Даниэлем Резерфордом в 1772 году.[33] В природе он встречается в виде двух изотопов: азот-14 и азот-15.[34]
Многие важные для промышленности вещества, такие как аммиак, азотная кислота, органические нитраты (ракетное топливо, взрывчатые вещества) и цианиды, содержат азот. В химии элементарного азота преобладает чрезвычайно сильная химическая связь, в результате чего возникают трудности как для организмов, так и при промышленном производстве в разрушении этой связи при преобразовании молекулы N2 в полезные соединения. Но в то же время такое успешное преобразование вызывает потом высвобождение большого количества энергии, если такие соединения сжечь, взорвать или другим способом преобразовать азот обратно в газообразное двухатомное состояние.
Азот присутствет во всех живых организмах, а круговорот азота описывает движение элемента из воздуха в биосферу и органические соединения, и затем обратно в атмосферу. Искусственно произведённые нитраты являются ключевыми ингредиентами промышленных удобрений, а также основными загрязняющими веществами при возникновении эвтрофикации водных систем. Азот является составной частью аминокислот, а, следовательно, белков и нуклеиновых кислот (ДНК и РНК). Он находится в химической структуре практически всех нейротрансмиттеров и является определяющим компонентом алкалоидов и биологических молекул, производимых многими организмами.[35]
Кислород[править | править код]
Кислород (O) является химическим элементом с атомным номером 8, встречающемся в природе в виде 16O, 17O и 18O, среди которых самым распространённым изотопом является 16O.[36]
Фтор[править | править код]
Фтор (F) является химическим элементом с атомным номером 9, имеющем единственный стабильный изотоп 19F.[37] Чрезвычайно химически активный неметалл и сильнейший окислитель.
Неон[править | править код]
Неон (Ne) является химическим элементом с атомным номером 10, встречающемся в природе в виде 20Ne, 21Ne и 22Ne.[38]
- ↑ 1 2 Lithium at WebElements.
- ↑ 1 2 Isotopes of Lithium (неопр.). Berkley Lab, The Isotopes Project. Дата обращения 21 апреля 2008. Архивировано 31 июля 2012 года.
- ↑ Krebs, Robert E. The History and Use of Our Earth’s Chemical Elements: A Reference Guide (англ.). — Westport, Conn.: Greenwood Press, 2006. — P. 47—50. — ISBN 0-313-33438-2.
- ↑ 1 2 Kamienski et al. «Lithium and lithium compounds». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2004. DOI:10.1002/0471238961.1209200811011309.a01.pub2
- ↑ Cade J. F. J. Lithium salts in the treatment of psychotic excitement (англ.) // Medical Journal of Australia (англ.)русск. : journal. — 1949. — Vol. 2, no. 10. — P. 349—352. — PMID 18142718.
- ↑ P. B. Mitchell,D. Hadzi-Pavlovic. Lithium treatment for bipolar disorder (англ.) // Bulletin of the World Health Organization (англ.)русск.. — World Health Organization, 2000. — Vol. 78, no. 4. — P. 515—517. — PMID 10885179.
- ↑ Baldessarini R. J., Tondo L., Davis P., Pompili M., Goodwin F. K., Hennen J. Decreased risk of suicides and attempts during long-term lithium treatment: a meta-analytic review (англ.) // Bipolar disorders : journal. — 2006. — October (vol. 8, no. 5 Pt 2). — P. 625—639. — DOI:10.1111/j.1399-5618.2006.00344.x. — PMID 17042835.
- ↑ 1 2 3 4 5 Beryllium at WebElements.
- ↑ Standards and properties of beryllium copper.
- ↑ Information about beryllium tweeters.
- ↑ IARC Monograph, Volume 58 (неопр.). International Agency for Research on Cancer (1993). Архивировано 31 июля 2012 года.
- ↑ Information Архивная копия от 31 марта 2001 на Wayback Machine about chronic beryllium disease.
- ↑ 1 2 3 Boron at WebElements.
- ↑ 1 2 3 Properties of boron.
- ↑ W.T.M.L. Fernando, L.C. O’Brien, P.F. Bernath. Fourier Transform Spectroscopy: B4Σ−−X4Σ− (неопр.) (PDF). University of Arizona, Tucson. Архивировано 31 июля 2012 года.
- ↑ K.Q. Zhang, B.Guo, V. Braun, M. Dulick, P.F. Bernath. Infrared Emission Spectroscopy of BF and AIF (неопр.) (PDF). University of Waterloo, Waterloo, Ontario. Архивировано 31 июля 2012 года.
- ↑ Compound Descriptions: B2F4 (неопр.). Landol Börnstein Substance/Property Index.
- ↑ Functions of Boron in Plant Nutrition (неопр.) (PDF) (недоступная ссылка). U.S. Borax Inc.. Архивировано 18 августа 2003 года.
- ↑ Blevins, Dale G.; Lukaszewski, Krystyna M. Functions of Boron in Plant Nutrition (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1998. — Vol. 49. — P. 481—500. — DOI:10.1146/annurev.arplant.49.1.481. — PMID 15012243.
- ↑ Zook EG and Lehman J. 850-5 (неопр.) // J. Assoc. Off Agric. Chem. — 1965. — Т. 48.
- ↑ Boron (неопр.). PDRhealth. Дата обращения 18 сентября 2008. Архивировано 24 мая 2008 года.
- ↑ 1 2 3 4 Carbon at WebElements.
- ↑ Amorphous carbon // IUPAC Compendium of Chemical Terminology (неопр.). — 2nd. — International Union of Pure and Applied Chemistry, 1997.
- ↑ Vander Wal, R. Soot Precursor Material: Spatial Location via Simultaneous LIF-LII Imaging and Characterization via TEM (англ.) // NASA Contractor Report : journal. — 1996. — May (no. 198469). Архивировано 17 июля 2009 года. Архивная копия от 17 июля 2009 на Wayback Machine
- ↑ diamond-like carbon films // IUPAC Compendium of Chemical Terminology (неопр.). — 2nd. — International Union of Pure and Applied Chemistry, 1997.
- ↑ 1 2 Presentation about isotopes by Mahananda Dasgupta of the Department of Nuclear Physics at Australian National University.
- ↑ Plastino, W.; Kaihola, L.; Bartolomei, P.; Bella, F. Cosmic Background Reduction In The Radiocarbon Measurement By Scintillation Spectrometry At The Underground Laboratory Of Gran Sasso (англ.) // Radiocarbon : journal. — 2001. — Vol. 43, no. 2A. — P. 157—161. Архивировано 27 мая 2008 года. Архивировано 27 мая 2008 года.
- ↑ Ten most abundant elements in the universe, taken from The Top 10 of Everything, 2006, Russell Ash, page 10. Архивировано 10 февраля 2010 года.
- ↑ Chang, Raymond. Chemistry, Ninth Edition (неопр.). — McGraw-Hill Education, 2007. — С. 52. — ISBN 0-07-110595-6.
- ↑ Freitas Jr., Robert A. Nanomedicine, (итал.). — Landes Bioscience (англ.)русск., 1999. — С. Tables 3—1 & 3—2. — ISBN 1570596808.
- ↑ 1 2 3 Structure and Nomenclature of Hydrocarbons (неопр.). Purdue University. Архивировано 31 июля 2012 года.
- ↑ 1 2 3 4 Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter. Molecular Biology of the Cell (неопр.). — Garland Science (англ.)русск..
- ↑ Lavoisier, Antoine Laurent. Elements of chemistry, in a new systematic order: containing all the modern discoveries (англ.). — Courier Dover Publications, 1965. — P. 15. — ISBN 0486646246.
- ↑ Nitrogen at WebElements.
- ↑ Rakov, Vladimir A.; Uman, Martin A. Lightning: Physics and Effects (неопр.). — Cambridge University Press, 2007. — С. 508. — ISBN 9780521035415.
- ↑ Oxygen Nuclides / Isotopes (неопр.). EnvironmentalChemistry.com.
- ↑ National Nuclear Data Center. NuDat 2.1 database – fluorine-19 (неопр.). Brookhaven National Laboratory. Архивировано 31 июля 2012 года.
- ↑ Neon: Isotopes (неопр.). Softciências. Архивировано 31 июля 2012 года.



