Литий металл. Свойства лития. Применение лития
Описание и свойства лития
Литий – элемент, с отношением к первой группе, во втором периоде таблицы, его атомный номер – 3. Формула лития — Li2O. Элемент открыли в 1817 г., был произведён только 1825 г. Название дословно переводится как «камень».

Литий – это металл, с щелочными свойствами, серебристого цвета, обладающий выраженными пластичными свойствами. Легко поддаётся обработке. Характерен наиболее большой температурой плавления, это 180,54º С, кипения — 1340º С и низкой плотностью по сравнению с остальными металлами щелочного ряда. Его плотность ниже плотности воды. Это позволяет ему оставаться на плаву на водной поверхности и даже в керосине.
Атом лития своими небольшими размерами позволяет металлу выказывать определённые свойства. Смешение с натрием происходит только в определённой температуре,а с цезием, рубидием и кадмием, он не смешиваться вовсе. Остальные металлы этого ряда подобными свойствами не обладают.
Не смотря на то, что литий это металл с щелочных свойств, он наименее активный из всех прочих, и с кислородом не взаимодействует, с сухим тоже. Поэтому хранить его в керосине, защищая от взаимодействия с кислородной средой, как это делается с другим щелочным металлам, нет необходимости.
К тому же это бесполезно – на практике он всё равно всплывёт на поверхность. Поэтому его можно спокойно хранить на открытом воздухе длительное время, не опасаясь, что в нём произойдут нежелательные изменения.

При достаточной влажности происходит реакция с азотом и другими газами, растворёнными в воздухе. Превращения зависят от свойств контактирующего агента (газа). Может образоваться гидроксид, карбонат или нитрит лития. В процессе нагревания в кислородной среде образуется оксид лития Li2O.
Определить литий несложно – оказавшись в открытом пламени, он окрашивает его своеобразными красными оттенками. Самовоспламеняется при 300º С. Следует быть осторожным при этих процессах, так как продукты его горения раздражающе действуют на оболочки дыхательных путей, а также глаза. Также он может вызвать ожоги, попадая на мокрую кожу.
Реакция на воду спокойная, при неё образуется гидроксид лития и водород. Также характерны реакции с этилом, водородом, и аммиаком. Реакция на серу происходит при 130º С, с образованием сульфидов. На углерод реагирует при 200º С, в полном вакууме, во время этого образуется ацетиленид. Растворяясь в аммиаке, образует раствор синеватого цвета.
При необходимости длительного хранения литий хранится в отдельных коробках из жести, погружённый в петролинейный эфир или парафин.
Месторождения и добыча лития
Литий представитель литофильных фрагментов ионного происхождения, из них можно отметить цезий, калий и рубидий. К основным минералам, содержащим литий, относятся пироксен, сподумен, слюда и лепидолит. Помимо его нахождения в самостоятельно образованных минералах, его можно обнаружить на месте калия в сторонних соединениях.

Образование лития происходит на почве редкометальных гранитных интрузий, в литиеносных пегматитах или гидротермальных месторождениях, которые помимо лития, в комплексе с вольфрамом, висмутом, оловом и т.д. Наиболее высокая концентрация лития, присуща породам онгонитам – гранитам, содержащих большое количество воды и фтористых образований.
В определённом количестве литий содержит вода в сильносолёных озёрах. Его месторождения имеются в Бразилии, Аргентине, Чили, Канаде, США, Конго, Швеции, Испании, Афганистане, Китае, и Австралии. А также в России, где половина залежей содержащих этот элемент, находится в Мурманской области.
Применение лития
Литий применяется в изготовлении керамики и стеклянной продукции, источников напряжения, горюче-смазочных материалов и полимеров, а также в металлургической промышленности и фармацевтике.

Нередко для устройства требуется мощный и ёмкий аккумулятор. Литий наиболее подходящая составляющая для его изготовления. Если для начинки используется литий, батарея прослужит гораздо дольше. Можно отметить, например, литий-ионный тип подзаряжающихся батарей.
Купить аккумуляторы литийного типа можно двух типов. Разница заключается в используемых электролитах. Литий-ионный аккумулятор – содержит электролит гелевого типа. Модель используется для питания большинства портативной электротехники, в частности, сотовых телефонах, ноутбуках, цифровых фотоаппаратах и видеокамерах.
Литий-полимерный аккумулятор – усовершенствованный вариант первого. В виде начинки используется полимер, содержащий литий. Для устройств имеющих большое потребление энергии, более подходит литий-полимерный вариант.
Также литий добавляют в электролиты других типов аккумулирующих устройств, например, щелочного вида. Это значительно повышает их ёмкость и срок эксплуатации.

Литий, в частности, применяется в металлургической промышленности при изготовления различных необходимых сплавов. Изготовляются сплавы с золотом, серебром, кадмием, магнием, и медью. Эти сплавы нашли своё применение в различных космических и авиационных технологиях.
Для военных нужд, с применением лития, изготовляются керамические элементы для различной техники и особо крепкое стекло. Также он используется в радиотехнических и оптических областях. Литий также применяется в металлогалогеновых лампах.
Идёт этот металл и на медицинские нужды. Доказано, что в небольшом количестве он необходим для нормальной работы организма. Его содержат все внутренние органы. Он участвует во многих обменных процессах и стимулирует иммунитет. Он применяется в препаратах для лечения психологических заболеваний и благотворно сказывается на работе нервной системы.
Цена лития
До 2008 г цена на литий постепенно росли, потом в связи с экономическим кризисом заметно упали. Если в то время цена на килограмм лития составляла порядком 66 долларов, то позже она понизилась с отметки 6,5 тыс. долларов до 5 тыс. долларов за тонну продукта, и после почти не поменялась. Но данные расценки относятся к товару относительно низкого качества.
На более чистый продукт, идущий, например, на изготовление батарей, идёт соответствующая накрутка около 700-800 $. Производители, несмотря на это, предпочитают доплачивать за качество, поэтому доходы от надбавки пока стабильные. Резкого повышения цен в обозримом будущем не ожидается. Чистый литий купить можно будет, приблизительно, за 6 тыс. долларов за тонну.

Прогнозы мирового рынка лития дают определённые надежды на его развитие. Это в основном обусловлено новыми амбициозными проектами в области строения электромобилей, для которых использоваться будут соответственно литиевые аккумуляторы.
С каждым годом этот проект становится всё более реальным, в связи со злободневностью загрязнения окружающей среды выхлопными газами и повышенным спросом на доступные средства передвижения.
Особенно проблема актуальна для развивающихся стран. Но сама технология ещё сырая, в частности, это проблема с хорошими дорогами, и электрическими заправками. Поэтому крупных подвижек на мировом рынке лития в ближайшие годы не предвидится.
Литий-ионный аккумулятор — Википедия
 Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]
Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, который широко распространён в современной бытовой электронной технике и находит своё применение в качестве источника энергии в электромобилях и накопителях энергии в энергетических системах. Это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты, видеокамеры и электромобили.
Основной источник: [2]Впервые принципиальная возможность создания литиевых аккумуляторов на основе способности дисульфид титана или дисульфид молибдена включать в себя ионы лития при разряде аккумулятора и экстрагировать их при зарядке была показана в 1970 году Майклом Стэнли Уиттингемом. Существенным недостатком таких аккумуляторов являлось низкое напряжение — 2,3 В и высокая пожароопасность вследствие образования дендритов металлического лития, замыкающих электроды.
Позднее Дж. Гуденафом были синтезированы другие материалы для катода литиевого аккумулятора — кобальтит лития LixCoO2(1980 год), феррофосфат лития LiFePO4 (1996 год). Преимуществом таких аккумуляторов является более высокое напряжение — около 4 В.
Современный вариант литий-ионного аккумулятора с анодом из графита и катодом из кобальтита лития изобрёл в 1991 году Акира Ёсино. Первый литий-ионный аккумулятор по его патенту выпустила корпорация Sony в 1991 году.
В настоящее время ведутся исследования по поиску материалов на основе кремния и фосфора, обеспечивающих повышенную емкость интеркалирования ионов лития и по замене ионов лития на ионы натрия.
Нобелевская премия по химии 2019 года была вручена троим перечисленным выше учёным «За создание литий-ионных батарей».
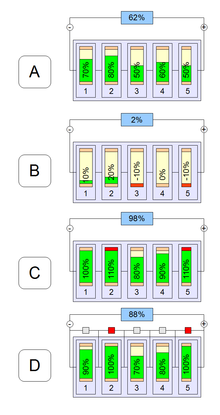 При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во время зарядки батареи
При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во время зарядки батареиХарактеристики литий-ионных аккумуляторов зависят от химического состава составляющих компонентов и варьируются в следующих пределах:
Контроллер заряда/разряда (плата защиты) цилиндрического литий-ионного аккумулятора, конструкционно припаянный к отрицательному контакту аккумулятора и обратной фольгированной стороной выполняющий его функции. На снимке частично демонтирован и отсоединён от проводника, идущего к положительному контакту аккумулятораЧасто в корпус аккумулятора встраивают контроллер защиты (или PCM-плата (англ. Protection Circuit Module)), который отключает аккумулятор, предотвращая превышение напряжения заряда, чрезмерный разряд и превышение температуры, приводящие его к преждевременной деградации или разрушению. Также этот контроллер может опционально ограничивать ток потребления. Тем не менее, надо учитывать, что не все аккумуляторы снабжаются защитой. В целях снижения стоимости производители могут не устанавливать её. Кроме того, в устройствах в которых встроен контроллер защиты, а также в аккумуляторных батареях (к примеру ноутбуков) используются только аккумуляторы без встроенной платы защиты
Литиевые аккумуляторы имеют специальные требования при подключении нескольких ячеек последовательно. Зарядные устройства для таких многосоставных аккумуляторов с ячейками или сами аккумуляторные батареи снабжаются схемой балансировки ячеек. Смысл балансировки в том, что электрические свойства ячеек могут немного отличаться, и какая-то ячейка достигнет полного заряда/разряда раньше других. При этом необходимо прекратить заряд этой ячейки, продолжая заряжать остальные, так как переразряд или перезаряд литий-ионных аккумуляторов выводит их из строя. Эту функцию выполняет специальный узел — балансир [en] (или BMS-плата (англ. Battery Management System)[7]). Он шунтирует заряженную ячейку так, чтобы ток заряда шёл мимо неё. Балансиры одновременно выполняют функцию платы защиты в отношении каждого из аккумуляторов, так и батареи в целом[8][9].
Зарядные устройства могут поддерживать конечное напряжение заряда в диапазоне 4,15—4,25В.
Кроме контроллера защиты, литий-ионные, а также литий-полимерные аккумуляторы выпускаемые в формфакторах АА и ААА с напряжением 1,5 В (не следует путать с аналогичного размера формфакторами 14500 и 10440 напряжением 3,7 В, а также с незаряжаемыми одноразовыми литиевыми элементами питания напряжением тоже 1,5 В) оборудуются встроенными электронными преобразователями напряжения. Отличие таких аккумуляторов — стабилизированное напряжение на выходе на контактах в 1,5 В независимо от
Литий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделённых пористым сепаратором, пропитанным электролитом. Пакет электродов помещён в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъёмникам. Корпус иногда оснащают предохранительным клапаном, сбрасывающим внутреннее давление при аварийных ситуациях или нарушениях условий эксплуатации. Литий-ионные аккумуляторы различаются по типу используемого катодного материала. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет способность внедряться (интеркалироваться) в кристаллическую решётку других материалов (например, в графит, оксиды и соли металлов) с образованием химической связи, например: в графит с образованием LiC 6, оксиды (LiMnO2) и соли (LiMnRON) металлов.
Первоначально в качестве отрицательных пластин применялся металлический литий, затем — каменноугольный кокс. В дальнейшем стал применяться графит. Применение оксидов кобальта позволяет аккумуляторам работать при значительно более низких температурах, повышает количество циклов разряда/заряда одного аккумулятора. Распространение литий-железо-фосфатных аккумуляторов обусловлено их относительно низкой стоимостью. Литий-ионные аккумуляторы применяются в комплекте с системой контроля и управления — СКУ или BMS (battery management system), — и специальным устройством заряда/разряда.
В настоящее время в массовом производстве литий-ионных аккумуляторов используются три класса катодных материалов:
- кобальтат лития LiCoO2 и твёрдые растворы на основе изоструктурного ему никелата лития
- литий-марганцевая шпинель LiMn2O4
- литий-феррофосфат LiFePO4.
Электрохимические схемы литий-ионных аккумуляторов:
- литий-кобальтовые LiCoO2 + 6C → Li1-xCoO2 + LiC6
- литий-ферро-фосфатные LiFePO4 + 6C → Li1-xFePO4 + LiC6
Благодаря низкому саморазряду и большому количеству циклов заряда/разряда, Li-ion-аккумуляторы наиболее предпочтительны для применения в альтернативной энергетике. При этом, помимо системы СКУ они укомплектовываются инверторами (преобразователи напряжения).
- Высокая энергетическая плотность (ёмкость).[источник не указан 680 дней]
- Низкий саморазряд.
- Высокий ток работы
- Не требуют обслуживания.
Широко применяемые литий-ионные аккумуляторы при перезаряде, несоблюдении условий заряда или при механическом повреждении часто бывают чрезвычайно огнеопасными.
- Огнеопасны
- Теряют работоспособность при переразряде
- Теряют ёмкость на холоде
- От 200 до 500 циклов зарядки
Взрывоопасность[править | править код]
 | Статья или раздел содержит противоречия и не может быть понята однозначно. Следует разрешить эти противоречия, используя более точные авторитетные источники или корректнее их цитируя. На странице обсуждения должны быть подробности. |

Аккумуляторы Li-ion первого поколения были подвержены взрывному эффекту. Это объяснялось тем, что в них использовался анод из металлического лития, на котором в процессе многократных циклов зарядки/разрядки возникали пространственные образования (дендриты), приводящие к замыканию электродов и, как следствие, возгоранию или взрыву. Этот недостаток удалось окончательно устранить заменой материала анода на графит. Подобные процессы происходили и на катодах литий-ионных аккумуляторов на основе оксида кобальта при нарушении условий эксплуатации (перезарядке). Литий-ферро-фосфатные аккумуляторы полностью лишены этих недостатков. Кроме того, все современные зарядные устройства для литий-ионных аккумуляторов предотвращают перезаряд и перегрев вследствие слишком интенсивного заряда.[источник не указан 559 дней]
Литиевые аккумуляторы изредка проявляют склонность к взрывному самовозгоранию.[17][18][19] Интенсивность горения даже от миниатюрных аккумуляторов такова, что может приводить к тяжким последствиям. [20] Авиакомпании и международные организации принимают меры к ограничению перевозок литиевых аккумуляторов и устройств с ними на авиатранспорте.[21][22]
Самовозгорание литиевого аккумулятора очень плохо поддается тушению традиционными средствами. В процессе термического разгона неисправного или поврежденного аккумулятора происходит не только выделение запасенной электрической энергии, но и ряд химических реакций, выделяющих вещества для поддержания горения, горючие газы от электролита[23], а также в случае не LiFePO4 электродов[24], выделяется кислород. Потому вспыхнувший аккумулятор способен гореть без доступа воздуха и для его тушения непригодны средства изоляции от атмосферного кислорода. Более того, металлический литий активно реагирует с водой с образованием горючего газа водорода, потому тушение литиевых аккумуляторов водой эффективно только для тех видов аккумуляторов, где масса литиевого электрода невелика. В целом тушение загоревшегося литиевого аккумулятора неэффективно. Целью тушения может быть лишь снижение температуры аккумулятора и предотвращение распространения пламени
Эффект памяти[править | править код]
Традиционно считается, что, в отличие от Ni-Cd и Ni-MH аккумуляторов, Li-Ion аккумуляторы полностью избавлены от эффекта памяти. По результатам исследований учёных Института Пауля Шерера (Швейцария) в 2013 году этот эффект был таки обнаружен, но оказался ничтожен.[28]
Причиной его является то, что основой работы батареи являются процессы высвобождения и обратного захвата ионов лития, динамика которых ухудшается в случае неполной зарядки.[29] Во время зарядки ионы лития один за другим покидают частицы литий-феррофосфата, размер которых составляет десятки микрометров. Катодный материал начинает разделяться на частицы с разным содержанием лития. Заряжание батареи происходит на фоне возрастания электрохимического потенциала. В определённый момент он достигает предельного значения. Это приводит к ускорению высвобождения оставшихся ионов лития из катодного материала, но они уже не меняют суммарного напряжения батареи. Если батарея не будет полностью заряжена, то на катоде останется некоторое число частиц, близких к пограничному состоянию. Они практически достигли барьера высвобождения ионов лития, но не успели его преодолеть. При разряде свободные ионы лития стремятся вернуться на место и рекомбинировать с ионами феррофосфата. Однако на поверхности катода их также встречают частицы в пограничном состоянии, уже содержащие литий. Обратный захват затрудняется, и нарушается микроструктура электрода.
В настоящее время просматриваются два пути решения проблемы: внесение изменений в алгоритмы работы системы управления батареями и разработка катодов с увеличенной площадью поверхности.
Требования к режимам заряда/разряда[править | править код]
Глубокий разряд полностью выводит из строя литий-ионный аккумулятор. Также на жизненный цикл аккумуляторов влияет глубина его разряда перед очередной зарядкой и зарядка токами выше установленных производителем. Крайне чувствительны они и к напряжению зарядки. Если его повысить всего на 4 %, то аккумуляторы будут вдвое быстрее терять ёмкость от цикла к циклу. Ток зарядки зависит от разницы напряжений между аккумулятором и зарядным устройством и от сопротивления как самого аккумулятора, так и подводимых к нему проводов. Поэтому увеличение напряжения зарядки на 4 % может приводить к увеличению тока зарядки в 10 раз. Это отрицательно сказывается на аккумуляторе. Он может перегреваться и деградировать[30].
Старение[править | править код]
Литиевые аккумуляторы стареют, даже если не используются. Соответственно, нет смысла покупать аккумулятор «про запас» или чрезмерно увлекаться «экономией» его ресурса.
Оптимальные условия хранения Li-ion-аккумуляторов достигаются при 40-процентном заряде от ёмкости аккумулятора и температуре 0…10 °C:[31]
| Температура, ⁰C | С 40%-м зарядом, % за год | Со 100%-м зарядом, % за год |
|---|---|---|
| 0 | 2 | 6 |
| 25 | 4 | 20 |
| 40 | 15 | 35 |
| 60 | 25 | 40 % за три месяца |
Снижение ёмкости при низких температурах[править | править код]
Как и в других типах аккумуляторов, разрядка в условиях низких температур приводит к снижению отдаваемой энергии, в особенности при температурах ниже 0 ⁰C. Так, снижение запаса отдаваемой энергии при понижении температуры от +20 ⁰C до +4 ⁰C приводит к уменьшению отдаваемой энергии на ~5-7 %, дальнейшее понижение температуры разрядки ниже 0 ⁰C приводит к потере отдаваемой энергии на десятки процентов. Разряд аккумулятора при температуре не ниже, указанной производителем аккумуляторов, не приводит к их деградации (преждевременному исчерпанию ресурса). Химия литий-ионных аккумуляторов более чувствительна к температурам при зарядке АКБ, и оно оптимально при температурах ~ +20 ⁰C, а при температурах ниже +5 ⁰C не рекомендовано.[32]
Как и для других типов аккумуляторов, одним из вариантов решения проблемы являются аккумуляторы с внутренним подогревом.[33]
- ↑ А.М. Скундин, О.А. Брылев. Наноматериалы в современных химических источниках тока (неопр.). МГУ (2011).
- ↑ Татьяна Кулова. Аккумуляторы, изменившие жизнь // Наука и жизнь. — 2019. — № 12. — С. 2-7.
- ↑ Li-ion 4.35V vs 4.20V сколько теряем? Тест SANYO UR18650ZTA. / Зарядки, пауэрбанки, провода и переходники / iXBT Live (рус.). iXBT Live (26 августа 2018). Дата обращения 18 октября 2019.
- ↑ Топовые аккумуляторы 21700: LG M50 5000мАч vs Samsung 48G 4800мАч / Зарядки, пауэрбанки, провода и переходники / iXBT Live (рус.). iXBT Live (30 июня 2018). Дата обращения 18 октября 2019.
- ↑ Sony VTC6A и VTC6 с одинаковыми Matrix-кодами — результаты тестов (неопр.). www.ecigtalk.ru. Дата обращения 18 октября 2019.
- ↑ Н. Бровка, О. Янченков Применение специализированных микропроцессоров для построения схем контроля и защиты литий-ионных и литий-полимерных аккумуляторных батарей // Журнал «Компоненты и Технологии». — № 3, 2007 г. С. 132—135. ISSN 2079-6811.
- ↑ Обзор BMS контроллера заряда литий-ионных аккумуляторов 18650 3.7В на YouTube
- ↑ Сердечный Д. В., Томашевский Ю. Б. Управление процессом заряда многоэлементных литий-ионных аккумуляторных батарей / Научная статья // Журнал «Измерение. Мониторинг. Управление. Контроль». — № 3 (21), 2017 г. С. 115—123. УДК 621.314. DOI 10.21685/2307-5538-2017-3-16. ISSN 1999-5458.
- ↑ Сазонов И. Е., Лукьяненко М. В. Выравнивание заряда в литий-ионных аккумуляторных батареях / Научная статья // Сборник материалов IX Междунарародной научно-практической конференции, посвящённой Дню космонавтики]]. «Актуальные проблемы авиации и космонавтики» [Электронныйресурс]. Красноярск: СибГУ им. М. Ф. Решетнева — № 9, т. 1, 2013 г. С. 204. УДК 537.22. ISSN 1999-5458.
- ↑ [1].
- ↑ [2].
- ↑ [3].
- ↑ [4]
- ↑ [5]
- ↑ [6].
- ↑ [7].
- ↑ Возгорания на Dreamliner связаны с аккумуляторами
- ↑ Samsung отзывает Galaxy Note 7 из-за возможности возгорания
- ↑ Находившийся за рулем Tesla бывший агент ФБР погиб в ДТП
- ↑ Should You Be Worried About Your E-Cigarette Exploding?
- ↑ Лайнер экстренно сел из-за загоревшегося планшета Samsung
- ↑ Lithium Batteries as Cargo in 2016 Update III
- ↑ Bandhauer Todd M., Garimella Srinivas, Fuller Thomas F. A Critical Review of Thermal Issues in Lithium-Ion Batteries (англ.) // Journal of The Electrochemical Society. — 2011. — Vol. 158, no. 3. — P. R1. — ISSN 0013-4651. — DOI:10.1149/1.3515880. [исправить]
- ↑ Zaghib K., Dubé J., Dallaire A., Galoustov K., Guerfi A., Ramanathan M., Benmayza A., Prakash J., Mauger A., Julien C.M. Enhanced thermal safety and high power performance of carbon-coated LiFePO4 olivine cathode for Li-ion batteries (англ.) // Journal of Power Sources. — 2012. — December (vol. 219). — P. 36—44. — ISSN 0378-7753. — DOI:10.1016/j.jpowsour.2012.05.018. [исправить]
- ↑ http://www.powerinfo.ru/accumulator-liion.php
- ↑ Гореть, а не тлеть! Что на самом деле случилось с электроседаном Tesla Motors?
- ↑ Аспекты безопасности литий-ионных аккумуляторов
- ↑ Paul Scherrer Institut (PSI) :: Memory effect now also found in lithium-ion batteries (неопр.). Дата обращения 2 мая 2013. Архивировано 11 мая 2013 года.
- ↑ Экономия батареи на Андроид: советы и мифы | AndroidLime (неопр.). androidlime.ru. Дата обращения 29 февраля 2016.
- ↑ Мельничук О. В., Фетисов В. С. Особенности заряда и разряда литиевых аккумуляторных батарей и современные технические средства управления этими процессами / Научная статья // Журнал «Электротехнические и информационные комплексы и системы». — № 2, т. 12, 2016 г. С. 41-48. УДК 621.355.9. ISSN 1999-5458.
- ↑ 5 практических советов по эксплуатации литий-ионных аккумуляторов (рус.)
- ↑ Эксплуатация и хранение литий-ионных аккумуляторов (рус.)
- ↑ Независимая интернет-газета «Новый взгляд». 22.01.2016.Созданы литий-ионные аккумуляторы с подогревом
№3 Литий
История открытия:
В 1817 г. шведский химик и минералог Август Арфведсон, анализируя природный минерал петалит, установил, что в нем содержится «огнепостоянная щелочь до сих пор неизвестной природы». Позднее он нашел аналогичные соединения в составе других минералов. Арфведсон предположил, что это соединения нового элемента и дал ему название литий (от греческого liqoz – камень).
Металлический литий был выделен в 1818 году английский химиком Гемфри Дэви электролизом расплава гидроксида лития.
Нахождение в природе и получение:
Природный литий состоит из двух стабильных изотопов — 6Li (7,42%) и 7Li (92,58%).
Литий — сравнительно мало распространенный элемент (массовая доля в земной коре 1,8*10-3%, 18 г/тонну). Кроме петалита LiAl[Si4O10], основными минералами лития являются слюда, лепидолит — KLi1,5Al1,5[Si3AlO10](F,OH)2 и пироксен сподумен — LiAl[Si2O6].
В настоящее время для получения металлического лития его природные минералы или обрабатывают серной кислотой, или спекают с CaO или CaCO3, а затем выщелачивают водой. Получают растворы сульфата или гидроксида лития, из которых осаждают плохо растворимый карбонат Li2CO3, который затем переводят в хлорид LiCl. Электролизом расплава хлорида лития в смеси с хлоридом калия или бария получают металлический литий.
Физические свойства:
Простое вещество литий — мягкий щелочной металл серебристо-белого цвета. Из всех щелочных металлов он самый твердый, высокоплавкий (Ткип=180,5 и Тпл=1340° С). Это самый легкий металл (плотность 0,533 г/см3), он плавает не только в воде, но и в керосине. Литий и его соли окрашивают пламя в карминно-красный цвет.
Химические свойства:
Литий проявляет типичные свойства щелочных металлов, взаимодействуя с водой, кислородом, другими неметаллами. Хранить его приходится под слоем под слоем минерального масла, придавливая сверху, чтобы не всплывал.
В соответствии с положением в ПСХЭ, литий наименее активный щелочной металл. Так в реакции с кислородом он образует в основном оксид лития, а не пероксиды как другие металлы. Подобно натрию литий растворяется в жидком аммиаке, образуя синий раствор с металлической проводимостью. Растворенный литий постепенно реагирует с аммиаком: 2Li + 2NH3 = 2LiNH2 + H2.
Литий отличается повышенной активностью при взаимодействии с азотом, образуя с ним уже при обычной температуре нитрид Li3N.
По некоторым свойствам литий и его соединения напоминают соединения магния (диагональное сходство в таблице Менделеева).
Важнейшие соединения:
Оксид лития, Li2O — белое кристаллическое вещество, основный оксид, с водой образует гидроксид
Гидроксид лития — LiOH — белый порошок, обычно моногидрат, LiOH*H2O, сильное основание
Соли лития — бесцветные кристаллические вещества, гигроскопичны, образуют кристаллогидраты состава LiX*3H2O. Карбонат и фторид лития подобно аналогичным солям магния малорастворимы.
Карбонат и нитрат лития при нагревании разлагаются, образуя оксид лития:
Li2CO3 = Li2O + CO2; 4LiNO3 = 2Li2O + 4NO2 + O2
Пероксид лития — Li2O2 — белое кристаллическое вещество, получают реакцией гидроксида лития с пероксидом водорода:
2LiOH + H2O2 = Li2O2 + 2H2O
Используют в космических аппаратах и подводных лодках для получения кислорода:
2Li2O2 + 2CO2 = 2Li2CO3 +O2
Гидрид лития LiH получают взаимодействием расплавленного лития с водородом. Бесцветные кристаллы, реагирует с водой и кислотами с выделением водорода. Источник водорода в полевых условиях.
Применение:
Металлический литий — высокопрочные и сверхлегкие сплавы с магнием и алюминием для авиационной и космической техники. Легирующая добавка в металлургии (связывает азот, кремний, углерод). Теплоноситель (расплав) в ядерных реакторах.
Из лития изготовляют аноды химических источников тока и гальванических элементов с твёрдым электролитом.
Соединения: специальные стекла, глазури, эмали, керамика. Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров
LiOH как добавка в электролит щелочных аккумуляторов. Карбонат лития – добавка в расплав при производстве алюминия: снижает температуру плавления электролита, увеличивает силу тока, уменьшает нежелательное выделение фтора.
Металлоорганические соединения лития (например бутиллитий LiС4Н9) — широко применяются в промышленном и лабораторном органическом синтезе и как катализаторы полимеризации.
Дейтерид лития-6: как источник дейтерия и трития в термоядерном оружии (водородная бомба). См. Ядерные реакции дейтерида лития. (анимированные модели).
Содержание лития в организме человека составляет около 70 мг. В течение суток в организм взрослого человека поступает около 100 мкг лития. Литий способствует высвобождению магния из клеточных «депо» и тормозит передачу нервного импульса, ингибируя проводимость нервной системы. Соли лития применяются психотропные лекарственные средства, оказывая успокаивающий эффект при лечении шизофрении и депрессии. Однако передозировка может привести к тяжелым осложнениям и летальному исходу.
Нурмаганбетов Т.
ТюмГУ, 582 группа, 2011 г.
Источники:
Литий // Википедия. URL: http://ru.wikipedia.org/wiki/Литий (дата обращения: 23.05.2013).
Литий // Онлайн Энциклопедия Кругосвет. URL: http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/LITI.html (дата обращения: 23.05.2013).
Литий
Ли́тий (лат. Lithium; обозначается символом Li) — элемент главной подгруппы первой группы, второго периода периодической системы химических элементов таблицы Менделеева, с атомным номером 3. Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году. Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т, в морской воде 0,17 мг/л. Основные минералы лития — слюда лепидолит — KLi1.5Al1.5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах. Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития. Другой тип месторождений лития — рассолы некоторых сильносоленых озёр. Месторождения Месторождения лития известны в России (более 50% запасов страны сосредоточено в редкометальных месторождениях Мурманской области), Боливии, Аргентине, Мексике, Афганистане, Чили, США, Канаде, Бразилии, Испании, Швеции, Китае, Австралии, Зимбабве, Конго.
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). 2LiCl = 2Li + Cl2 В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой. Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе. Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется. В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки. Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом (при 500—700 °C) с образованием гидрида лития, с аммиаком и с галогенами (с иодом — только при нагревании). При 130 °C реагирует с серой с образованием сульфида. В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид). При 600—700 °C литий реагирует с кремнием с образованием силицида. Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор. Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Источник: Википедия
Другие заметки по химии
Оксид лития — Википедия
Материал из Википедии — свободной энциклопедии
Окси́д ли́тия (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).[2]
- 4 Li+ O2⟶2 Li2O{\displaystyle {\mathsf {4\ Li+\ O_{2}\longrightarrow 2\ Li_{2}O}}}
- 2 Li2O2→195∘C 2 Li2O+ O2↑{\displaystyle {\mathsf {2\ Li_{2}O_{2}{\xrightarrow {195^{\circ }C}}\ 2\ Li_{2}O+\ O_{2}\uparrow }}}
- Взаимодействует с водой, образуя щёлочь:
- Li2O+h3O→ 2 LiOH{\displaystyle {\mathsf {\ Li_{2}O+H_{2}O{\xrightarrow {\ }}\ 2\ LiOH}}}
- Li2O+2 HCl→ 2 LiCl+h3O{\displaystyle {\mathsf {\ Li_{2}O+2\ HCl{\xrightarrow {\ }}\ 2\ LiCl+H_{2}O}}}
- литий из оксида вытесняется некоторыми металлами и неметаллами:
- Li2O+Mg→800∘C 2 Li+MgO{\displaystyle {\mathsf {\ Li_{2}O+Mg{\xrightarrow {800^{\circ }C}}\ 2\ Li+MgO}}}
- 2 Li2O+Si→1000∘C 4 Li+SiO2{\displaystyle {\mathsf {2\ Li_{2}O+Si{\xrightarrow {1000^{\circ }C}}\ 4\ Li+SiO_{2}}}}
- с кислотообразующими оксидами образует соли:
- Li2O+CO2→500∘C Li2CO3{\displaystyle {\mathsf {Li_{2}O+CO_{2}{\xrightarrow {500^{\circ }C}}\ Li_{2}CO_{3}}}}
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Литий-полимерный аккумулятор — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 января 2018; проверки требуют 30 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 января 2018; проверки требуют 30 правок. Литий-полимерный аккумулятор в герметичном мягком корпусе из металлизированной полимерной плёнки с контроллером. У аккумуляторов в мягкой оболочке прямоугольной формы в маркировке указываются габариты в виде 6-8 значной цифры: первые 2 цифры — толщина в десятых долях мм (в мм если первая цифра = 0), вторые 2 цифры (3 цифры при 8 значной маркировке) — ширина в мм, последние 2 цифры (3 цифры при 7-8 значной маркировке) — длина в мм (на фото: 063450 — 6 × 34 × 50 мм. Литий-полимерный аккумулятор сотового телефона в алюминиевом корпусе с контроллером
Литий-полимерные аккумуляторы в корпусе из полимерной плёнки разной формы без контроллеров
Литий-полимерный аккумулятор сотового телефона в алюминиевом корпусе с контроллером
Литий-полимерные аккумуляторы в корпусе из полимерной плёнки разной формы без контроллеровЛитий-полимерный аккумулятор (литий-ионный полимерный аккумулятор (lithium-ion polymer battery); аббревиатуры: Li-pol, Li-polymer, LIP, Li-poly и т. д.) — это усовершенствованная конструкция литий-ионного аккумулятора. В качестве электролита используется полимерный материал.[1] Используется в мобильных телефонах, цифровой технике, радиоуправляемых моделях и пр.
Обычные бытовые литий-полимерные аккумуляторы не способны отдавать большой ток, но существуют специальные силовые литий-полимерные аккумуляторы, способные отдавать ток, в 10 и даже 130[2] раз превышающий численное значение ёмкости в ампер-часах. Они широко применяются как аккумуляторы для радиоуправляемых моделей, а также в портативном электроинструменте и в некоторых современных электромобилях.
- Большая плотность энергии на единицу массы;
- Низкий саморазряд;
- Толщина элементов от 1 мм;
- Возможность получать очень гибкие формы;
- Слабо выраженный эффект памяти;
- Незначительный перепад напряжения по мере разряда.
- Диапазон рабочих температур литий-полимерных аккумуляторов довольно широкий: от −20 до +40 °C по данным производителей.
Аккумуляторы пожароопасны при перезаряде и/или перегреве. Для борьбы с этим явлением все бытовые аккумуляторы снабжаются встроенной электронной схемой, которая предотвращает перезаряд и перегрев вследствие слишком интенсивного заряда. По этой же причине требуют специальных алгоритмов зарядки (зарядных устройств).
Количество рабочих циклов 800—900, при разрядных токах в 2С до потери ёмкости в 20 % (для сравнения: NiCd — 1000 циклов, NiMH — 600, LSD NiMH — 1500, LiFePO4 — 2000).[3]
Старение[править | править код]
 Вздувшийся литий-полимерный аккумулятор в мягкой оболочке
Вздувшийся литий-полимерный аккумулятор в мягкой оболочкеПод воздействием заряда литий-полимерные и литий-ионные аккумуляторы снижают ёмкость в зависимости от температурного режима.
Глубокий разряд полностью выводит из строя литий-полимерный аккумулятор. Оптимальные условия хранения Li-pol аккумуляторов достигаются при 40%-м заряде от ёмкости аккумулятора. Литиевые аккумуляторы стареют, даже если не используются. На 2009 год бытовало мнение, что через 2 года батарея теряет около 20 % ёмкости[3]. Соответственно, нет необходимости покупать аккумулятор «про запас» или чрезмерно увлекаться «экономией» его ресурса. При покупке рекомендуется посмотреть на дату производства, чтобы знать, сколько данный источник питания уже пролежал на складе.
- ГОСТ 15596-82 Источники тока химические. Термины и определения.
Литий — Мегаэнциклопедия Кирилла и Мефодия — статья
Литий встречается в природе в виде двух стабильных нуклидов 6Li (7, 52% по массе) и 7Li (92, 48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов. Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1.Металлический радиус атома лития 0, 152 нм, радиус иона Li+ 0, 078 нм. Энергии последовательной ионизации атома лития 5, 39 и 75, 6 эВ. Электроотрицательность по Полингу 0, 98, самая большая у щелочных металлов.
В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li, Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F, OH)2. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х.Г.Гмелин в 1818 году. В этом же году английский химик Г. Дэви электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:2LiCl = 2Li + Cl2
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Литий довольно широко распространен в земной коре, его содержание в ней составляет 6, 5·10–3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3, 5-4, 9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2, O) и амблигонит LiAl [PO4] — 8-10 % Li2, O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10-5 % лития.Из металлов литий самый легкий, его плотность 0, 534 г/см3 . Температура плавления 180, 5 °C, температура кипения 1326 °C. При температурах от –193 °C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а=0, 350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний. Литий химически очень активен. Он способен взаимодействовать с кислородом и азотом воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию, нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = –3, 05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла:
Liтвердый Li+раствор + e–
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния или кальция. Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313, 5 г LiClO3).
Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2H2O = 2LiOH + Cl2 + H2
LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + H2O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом:
2Li + H2 = 2LiH
LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2, 8 м3 H2):
LiH + H2O = LiOH + H2
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[BH4] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий 31H (Т):
63Li + 10n = 31H + 42He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Литий в незначительных количествах присутствует в живых организмах, но по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0, 7 мг лития. Токсическая доза 90-200 мг.
Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития LiOH.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. М., 1970.
- Полуэктов Н. С., Мешкова С. Б., Полуэктова Е. Н. Аналитическая химия лития. М., 1975.
