Литий
Ли́тий (лат. Lithium; обозначается символом Li) — элемент главной подгруппы первой группы, второго периода периодической системы химических элементов таблицы Менделеева, с атомным номером 3. Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году. Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий.

Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). 2LiCl = 2Li + Cl2 В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе. Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li
3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H
Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.Источник: Википедия
Другие заметки по химии
Литий: способы получения и химические свойства
Литий — это щелочной металл, серебристо-белого цвета. Самый легкий из металлов, мягкий, низкая температура плавления.
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Качественная реакция на литий — окрашивание пламени солями лития в карминно-красный цвет.
Литий — активный металл; на воздухе реагирует с кислородом и азотом, и покрывается оксидно-нитридной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Литий — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. Литий легко реагирует с галогенами с образованием галогенидов:
2Li + I2 = 2LiI
1.2. Литий реагирует с серой с образованием сульфида лития:
2Li + S = Li2S
1.3. Литий активно реагирует с фосфором и водородом. При этом образуются бинарные соединения — фосфид лития и гидрид лития:
3Li + P = Li3P
2Li + H2 = 2LiH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
6Li + N2 = 2Li3N
1. 5. Литий реагирует с углеродом с образованием карбида:
5. Литий реагирует с углеродом с образованием карбида:
2Li + 2C = Li2C2
1.6. При взаимодействии с кислородом литий образует оксид.
4Li + O2 = 2Li2O
2. Литий активно взаимодействует со сложными веществами:
2.1. Литий бурно реагирует с водой. Взаимодействие лития с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2Li0 + H2+O = 2Li+OH + H20
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Литий взаимодействует с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
При этом образуются соль и водород.
Например, литий бурно реагирует с соляной кислотой:
2Li + 2HCl = 2LiCl + H2↑
2.3. При взаимодействии лития с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии лития с концентрированной серной кислотой образуется сульфат лития, диоксид серы и вода:
2Li + 3H2SO4(конц.) = 2LiHSO4 + SO2↑ +2H2O
2.4. Литий реагирует с азотной кислотой:
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ +2H2O
2.5. Литий может реагировать даже с веществами, которые проявляют очень слабые кислотные свойства. Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами, фенолом и органическими кислотами.
Например, при взаимодействии лития с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
2.6. В расплаве литий может взаимодействовать с некоторыми солями. Обратите внимание! В растворе литий будет взаимодействовать с водой, а не с солями других металлов.
Например, литий взаимодействует в расплаве с хлоридом алюминия :
3Li + AlCl3 → 3LiCl + Al
Понравилось это:
Нравится Загрузка…
Литий (Li) — Химические свойства, влияние на здоровье и окружающую среду
Литий является первой щелочью в периодической таблице. В природе встречается как смесь изотопов Li 6 и Li 7 . Это самый легкий твердый металл, он мягкий, серебристо-белый, с низкой температурой плавления и реактивный.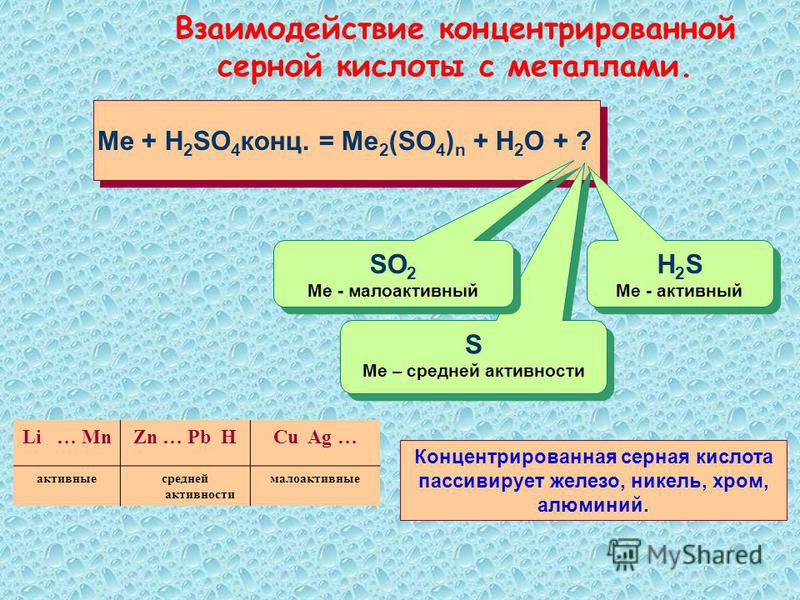 Многие из его физических и химических свойств больше похожи на свойства щелочноземельных металлов, чем на свойства его собственной группы.
Многие из его физических и химических свойств больше похожи на свойства щелочноземельных металлов, чем на свойства его собственной группы.
Среди наиболее значимых свойств лития мы находим его высокую удельную теплоемкость (теплотворность), огромный температурный интервал в жидком состоянии, высокую теплопроводность, низкую вязкость и очень низкую плотность. Металлический литий растворим в короткоцепочечных алифатических аминах, таких как этиламин. Не растворяется в углеводородах.
Литий принимает участие в огромном количестве реакций как с органическими, так и с неорганическими реагентами. Реагирует с кислородом с образованием монооксида и пероксида. Это единственный щелочной металл, который реагирует с азотом при температуре окружающей среды с образованием черной нитруры. Он легко реагирует с водородом почти при 500ºC (930ºF) с образованием гидрида лития. Реакция металлического лития с водой протекает чрезвычайно энергично. Литий вступает в реакцию непосредственно с углеродом, образуя карбюратор. Он легко связывается с галогенами и образует галогениды со световым излучением. Хотя он не реагирует с парафиновыми углеводородами, он экспериментирует с реакциями присоединения с алкенами, замещенными арильной и диеновой группами. Он также реагирует с ацетиленовыми соединениями, образуя ацетилуры лития, которые играют важную роль в синтезе витамина А.
Он легко связывается с галогенами и образует галогениды со световым излучением. Хотя он не реагирует с парафиновыми углеводородами, он экспериментирует с реакциями присоединения с алкенами, замещенными арильной и диеновой группами. Он также реагирует с ацетиленовыми соединениями, образуя ацетилуры лития, которые играют важную роль в синтезе витамина А.
Области применения
Основным соединением лития является гидроксид лития. Это белый порошок; изготовленный материал представляет собой моногидрат гидроксида лития. Карбонат можно использовать в гончарной промышленности и в медицине в качестве антидепрессанта. И бром, и хлорид лития образуют концентрированный рассол, обладающий свойством поглощать влагу в широком интервале температур; эти рассолы используются в производимых системах кондиционирования воздуха.
Литий в основном используется в промышленности в форме стеарата лития в качестве загустителя консистентной смазки. Другие важные применения соединений лития находятся в гончарном деле, особенно в глазури для фарфора; в качестве добавки для продления срока службы и производительности щелочных аккумуляторных батарей, а также при автогенной сварке и сварке латуни.
Сплавы металла с алюминием, кадмием, медью и марганцем используются для изготовления деталей самолетов с высокими эксплуатационными характеристиками.
Литий в окружающей среде
Как и все щелочные металлы, литий легко вступает в реакцию в воде и не встречается свободно в природе из-за своей активности. за миллион). Это ставит литий ниже никеля, меди и вольфрама и выше церия и олова, что означает изобилие.
В Соединенных Штатах литий извлекают из бассейнов с соляным раствором в Неваде. Сегодня большая часть коммерческого лития извлекается из солевых источников в Чили. Мировое производство литиевых руд и солей бронзы составляет около 40 000 тонн в год, а запасы оцениваются примерно в 7 миллионов тонн.
Литий легко усваивается растениями. Количество лития в растениях колеблется в широких пределах, достигая в некоторых случаях 30 ppm.
Последствия воздействия лития: Огонь: легко воспламеняется. Многие реакции могут привести к возгоранию или взрыву. При пожаре выделяет раздражающие или токсичные пары (или газы). Взрыв: Опасность возгорания и взрыва при контакте с горючими веществами и водой. Вдыхание: Ощущение жжения. Кашель. Затрудненное дыхание. Сбивчивое дыхание. Больное горло. Симптомы могут проявиться позже. Кожа: покраснение. Кожа горит. Боль. волдыри. Глаза: покраснение. Боль. Тяжелые глубокие ожоги. Проглатывание: Спазмы в животе. Боль в животе. Обжигающее ощущение. Тошнота. Шок или коллапс. Рвота. Слабость.
При пожаре выделяет раздражающие или токсичные пары (или газы). Взрыв: Опасность возгорания и взрыва при контакте с горючими веществами и водой. Вдыхание: Ощущение жжения. Кашель. Затрудненное дыхание. Сбивчивое дыхание. Больное горло. Симптомы могут проявиться позже. Кожа: покраснение. Кожа горит. Боль. волдыри. Глаза: покраснение. Боль. Тяжелые глубокие ожоги. Проглатывание: Спазмы в животе. Боль в животе. Обжигающее ощущение. Тошнота. Шок или коллапс. Рвота. Слабость.
Последствия кратковременного воздействия : Вещество разъедает глаза, кожу и дыхательные пути. Разъедает при проглатывании. Вдыхание вещества может вызвать отек легких. Симптомы отека легких часто проявляются только через несколько часов и усиливаются при физической нагрузке. Поэтому необходимы покой и медицинское наблюдение. Следует рассмотреть вопрос о немедленном применении соответствующего спрея врачом или уполномоченным им лицом.
Пути воздействия : Вещество может проникать в организм при вдыхании аэрозоля и при приеме внутрь. Риск при вдыхании: Испарение при 20°C незначительно; однако опасная концентрация частиц в воздухе может быть быстро достигнута при распылении.
Риск при вдыхании: Испарение при 20°C незначительно; однако опасная концентрация частиц в воздухе может быть быстро достигнута при распылении.
Химическая опасность: Нагревание может привести к сильному воспламенению или взрыву. Вещество может самовозгораться при контакте с воздухом в мелкодисперсном состоянии. При нагревании образуются ядовитые пары. Реагирует бурно с сильными окислителями, кислотами и многими соединениями (углеводороды, галогены, галоны, бетон, песок и асбест) с опасностью пожара и взрыва. Реагирует бурно с водой с образованием легковоспламеняющегося газообразного водорода и едких паров гидроксида лития.
Металлический литий вступает в реакцию с азотом, кислородом и парами воды в воздухе. Следовательно, поверхность лития покрывается смесью гидроксида лития (LiOH), карбоната лития (Li 2 CO3) и нитрида лития (Li 3 N). Гидроксид лития представляет собой потенциально значительную опасность, поскольку он чрезвычайно коррозионно-активен. Особое внимание следует уделить водным организмам.
Особое внимание следует уделить водным организмам.
Подробнее о литии в воде
Вернуться к периодической таблице элементов .
Измеряемые электрические свойства нормальных и злокачественных тканей человека в диапазоне частот от 50 до 900 МГц
. 1994 апр; 21 (4): 547-50.
дои: 10.1118/1.597312.
W T Соединения 1 , Y Zhang, C Li, R L Jirtle
принадлежность
- 1 Университет Дьюка, Дарем, Северная Каролина 27708.
- PMID: 8058021
- DOI:
10.
 1118/1.597312
1118/1.597312
В. Т. Джойнс и др. мед. физ. 1994 апрель
. 1994 апр; 21 (4): 547-50.
дои: 10.1118/1.597312.
Авторы
W T Соединения 1 , И. Чжан, К. Ли, Р. Л. Джиртл
принадлежность
- 1 Университет Дьюка, Дарем, Северная Каролина 27708.
- PMID: 8058021
- DOI: 10.1118/1.597312
Абстрактный
Электропроводность и относительная диэлектрическая проницаемость злокачественных и нормальных тканей человека измерялись на частотах от 50 до 900 МГц.
Похожие статьи
Сравнение с использованием электрических свойств ткани и повышения температуры для определения относительного поглощения мощности микроволн в злокачественной ткани.
Джойнс В.Т., Шривастав С., Джиртл Р.Л. Джойнс WT и др. мед. физ. 1989 ноябрь-декабрь; 16 (6): 840-4. дои: 10.1118/1.596308. мед. физ. 1989. PMID: 2586369
Крупномасштабное измерение диэлектрических свойств нормальных и злокачественных колоректальных тканей, полученных в результате операций по удалению рака, на частотах Лармора.

Ли З., Дэн Г., Ли З., Синь С. С., Дуань С., Лань М., Чжан С., Гао И., Он Дж., Чжан С., Тан Х., Ван В., Хань С., Ян Ц.С., Чжуан Л., Ху Дж., Лю Ф. Ли Зи и др. мед. физ. 2016 ноябрь;43(11):5991. дои: 10.1118/1.4964460. мед. физ. 2016. PMID: 27806614
Диэлектрические свойства для неинвазивного обнаружения нормальных, доброкачественных и злокачественных тканей молочной железы с использованием микроволновых теорий.
Ченг Ю, Фу М. Ченг Ю и др. Рак грудной клетки. 2018 апр;9(4):459-465. дои: 10.1111/1759-7714.12605. Epub 2018 21 февраля. Рак грудной клетки. 2018. PMID: 29465782 Бесплатная статья ЧВК.
Оценка современных технологий гипертермии.
Аткинсон ER. Аткинсон ER. Рак Рез.
 1979 июнь; 39 (6 часть 2): 2313-24.
Рак Рез. 1979.
PMID: 376119
Обзор.
1979 июнь; 39 (6 часть 2): 2313-24.
Рак Рез. 1979.
PMID: 376119
Обзор.Биодиэлектрическое явление для активной дифференцировки злокачественных и нормальных клеток: обзор.
Хоссейн С. Хоссейн С. Электромагн Биол Мед. 2020 2 апр; 39(2):89-96. дои: 10.1080/15368378.2020.1737804. Epub 2020 5 марта. Электромагн Биол Мед. 2020. PMID: 32138569Обзор.
Посмотреть все похожие статьи
Цитируется
Емкостная сенсорная матрица на основе КМОП для характеристики и отслеживания биологических клеток.
Абдельбасет Р., Эль-Сехрави Ю., Морси О.Э., Галлаб Ю.Х., Исмаил Ю. Абдельбасет Р. и соавт. Научный представитель 2022 г., 16 августа; 12 (1): 13839.
 doi: 10.1038/s41598-022-18005-1.
Научный представитель 2022.
PMID: 35974084
Бесплатная статья ЧВК.
doi: 10.1038/s41598-022-18005-1.
Научный представитель 2022.
PMID: 35974084
Бесплатная статья ЧВК.Применение карты высокочастотной проводимости с использованием МРТ для ее оценки в мозге пациентов с болезнью Альцгеймера.
Пак С., Юнг С.М., Ли М.Б., Ри Х.И., Рю К.В., Чо А.Р., Квон О.И., Джанг Г.Х. Парк С. и др. Фронт Нейрол. 2022 16 мая; 13:872878. doi: 10.3389/fneur.2022.872878. Электронная коллекция 2022. Фронт Нейрол. 2022. PMID: 35651350 Бесплатная статья ЧВК.
Дизайн и характеристика РЧ-аппликатора для испытаний электромагнитной гипертермии in vitro.
Ферреро Р., Андрулакис И., Мартино Л., Надар Р., ван Рун Г.К., Манзин А. Ферреро Р. и др. Датчики (Базель). 2022 10 мая; 22(10):3610.
 дои: 10.3390/s22103610.
Датчики (Базель). 2022.
PMID: 35632018
Бесплатная статья ЧВК.
дои: 10.3390/s22103610.
Датчики (Базель). 2022.
PMID: 35632018
Бесплатная статья ЧВК.Микроволновая визуализация для раннего обнаружения рака молочной железы: текущее состояние, проблемы и будущие направления.
Аль-Савафта Н., Эль-Абед С., Доу С., Закария А. AlSawaftah N, et al. Дж Имиджинг. 2022 23 апреля; 8 (5): 123. doi: 10.3390/jimaging8050123. Дж Имиджинг. 2022. PMID: 35621887 Бесплатная статья ЧВК. Обзор.
Измерение диэлектрических свойств для быстрой дифференцировки грудных лимфатических узлов с использованием XGBoost у пациентов с немелкоклеточным раком легкого: клиническое исследование с самоконтролем.
Лу Д., Пэн Дж., Ван З., Сунь Й., Чжай Дж., Ван З., Чен З., Мацумото Й., Ван Л.


 1118/1.597312
1118/1.597312
 1979 июнь; 39 (6 часть 2): 2313-24.
Рак Рез. 1979.
PMID: 376119
Обзор.
1979 июнь; 39 (6 часть 2): 2313-24.
Рак Рез. 1979.
PMID: 376119
Обзор. doi: 10.1038/s41598-022-18005-1.
Научный представитель 2022.
PMID: 35974084
Бесплатная статья ЧВК.
doi: 10.1038/s41598-022-18005-1.
Научный представитель 2022.
PMID: 35974084
Бесплатная статья ЧВК. дои: 10.3390/s22103610.
Датчики (Базель). 2022.
PMID: 35632018
Бесплатная статья ЧВК.
дои: 10.3390/s22103610.
Датчики (Базель). 2022.
PMID: 35632018
Бесплатная статья ЧВК.